题目内容
下列过程中,不涉及氧化还原反应的是( )
| A、浓硫酸加入蔗糖固体中 | B、金属钠放置在空气中变质 | C、SO2使品红溶液褪色 | D、NO2形成酸雨 |
分析:在化学反应中有电子转移是氧化还原反应的本质,有元素化合价变化是氧化还原反应的特征,如果不涉及氧化还原反应,则该反应中元素化合价一定不发生变化,据此分析解答.
解答:解:A.浓硫酸加入蔗糖固体中,浓硫酸使蔗糖发生了脱水反应,该反应中硫元素化合价由+6价变为+4价,所以涉及氧化还原反应,故A错误;
B.钠和氧气反应生成氧化钠,该反应中氧元素化合价由0价变为-2价,所以涉及氧化还原反应,故B错误;
C.二氧化硫使品红溶液褪色,是因为二氧化硫和有色物质反应生成了无色物质,该反应中没有元素化合价变化,所以不涉及氧化还原反应,故C正确;
D.二氧化氮和水反应生成硝酸和一氧化氮,该反应中N元素化合价由+4价变为+5价和+2价,所以有元素化合价变化,涉及氧化还原反应,故D错误;
故选C.
B.钠和氧气反应生成氧化钠,该反应中氧元素化合价由0价变为-2价,所以涉及氧化还原反应,故B错误;
C.二氧化硫使品红溶液褪色,是因为二氧化硫和有色物质反应生成了无色物质,该反应中没有元素化合价变化,所以不涉及氧化还原反应,故C正确;
D.二氧化氮和水反应生成硝酸和一氧化氮,该反应中N元素化合价由+4价变为+5价和+2价,所以有元素化合价变化,涉及氧化还原反应,故D错误;
故选C.
点评:本题考查了氧化还原反应的判断,根据元素化合价是否变化来分析解答即可,注意氧化还原反应的特征和本质的区别,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2008?珠海一模)铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
(2008?珠海一模)铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )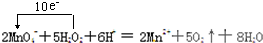
 MnO4- +
MnO4- + + 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O
+ 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O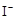 +2H+ = I2+2H2O
+2H+ = I2+2H2O 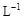 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 L(反应①,滴定过程中KMnO4不与过氧乙酸反应)。另取b0 L待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 L(反应①,滴定过程中KMnO4不与过氧乙酸反应)。另取b0 L待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·