题目内容
(2009?福建)[化学--物质结构与性质]
Q、R、X、Y、Z五种元素的原子序数依次递增.已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4.
请回答下列问题:
(1)Z2+的核外电子排布式是
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
Q、R、X、Y、Z五种元素的原子序数依次递增.已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4.
请回答下列问题:
(1)Z2+的核外电子排布式是
1s22s22p63s23p63d9
1s22s22p63s23p63d9
.(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的
孤对电子(孤电子对)
孤对电子(孤电子对)
形成配位键.(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是
b
b
.a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为
Si<C<N
Si<C<N
(用元素符号作答)(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为
3:2
3:2
.(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
原子晶体
原子晶体
.分析:(1)根据处于稳定状态(基态)的原子,核外电子将尽可能地按能量最低原理排布,电子排布遵守最低能量原理,泡利不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况;
(2)根据配位键的形成可知,单方提供孤对电子来分析解答;
(3)根据化学键来分析稳定性,利用分子间作用力来分析气态物质的沸点;
(4)根据非金属性的强弱及电子排布中半满状态来分析;
(5)根据结构式及判断σ键、π键的一般规律来分析解答;
(6)根据元素的性质分析元素,然后利用构成晶体的微粒及作用力来分析晶体类型.
(2)根据配位键的形成可知,单方提供孤对电子来分析解答;
(3)根据化学键来分析稳定性,利用分子间作用力来分析气态物质的沸点;
(4)根据非金属性的强弱及电子排布中半满状态来分析;
(5)根据结构式及判断σ键、π键的一般规律来分析解答;
(6)根据元素的性质分析元素,然后利用构成晶体的微粒及作用力来分析晶体类型.
解答:解:由29号为Cu元素.Y价电子:msnmpn中n只能取2,又为短周期,则Y可能为C或Si.R的核外L层为奇数,则可能为Li、B、N或F.Q、X的p轨道为2和4,则C(或Si)和O(或S).又五种元素原子序数依次递增.所以可推出:Q为C,R为N,X为O,Y为Si.
(1)Cu的价电子排布为3d104s1,失去两个电子,则为3d9,故答案为:1s22s22p63s23p63d9;
(2)Cu2+可以与NH3形成配合物,其中NH3中N提供孤对电子,Cu2+提供空轨道,而形成配位键,故答案为:孤对电子(孤电子对);
(3)Q、Y的氢化物分别为CH4和SiH4,由于C的非金属性强于Si,则稳定性CH4>SiH4.因为SiH4的相对分子质量比CH4大,故分子间作用力大,沸点高,故答案为:b;
(4)C、N和Si中,C、Si位于同一主族,则上面的非金属性强,故第一电离能大,而N由于具有半充满状态,故第一电离能比相邻元素大,所以N>C>Si,故答案为:Si<C<N;
(5)C、H形成的相对分子质量为26的物质为C2H2,结构式为H-C≡C-H,C-H之间单键是σ键,C≡C叁键中有两个是σ键一个π键,所以σ键与π键数之比为3:2,故答案为:3:2;
(6)电负性最大的非元素是O,最小的非金属元素是Si,两者构成的SiO2,构成微粒是原子,作用力是共价键,则属于原子晶体,故答案为:原子晶体.
(1)Cu的价电子排布为3d104s1,失去两个电子,则为3d9,故答案为:1s22s22p63s23p63d9;
(2)Cu2+可以与NH3形成配合物,其中NH3中N提供孤对电子,Cu2+提供空轨道,而形成配位键,故答案为:孤对电子(孤电子对);
(3)Q、Y的氢化物分别为CH4和SiH4,由于C的非金属性强于Si,则稳定性CH4>SiH4.因为SiH4的相对分子质量比CH4大,故分子间作用力大,沸点高,故答案为:b;
(4)C、N和Si中,C、Si位于同一主族,则上面的非金属性强,故第一电离能大,而N由于具有半充满状态,故第一电离能比相邻元素大,所以N>C>Si,故答案为:Si<C<N;
(5)C、H形成的相对分子质量为26的物质为C2H2,结构式为H-C≡C-H,C-H之间单键是σ键,C≡C叁键中有两个是σ键一个π键,所以σ键与π键数之比为3:2,故答案为:3:2;
(6)电负性最大的非元素是O,最小的非金属元素是Si,两者构成的SiO2,构成微粒是原子,作用力是共价键,则属于原子晶体,故答案为:原子晶体.
点评:本题考查物质结构与性质,明确位置、结构、性质的关系是解答的关键,此题综合性较强,涉及物质结构知识点比较多,考察比较全面,是一道不错的题.

练习册系列答案
相关题目
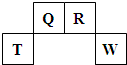 (2009?福建)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.
(2009?福建)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.

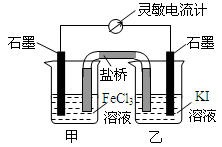 (2009?福建)控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如右图所示的原电池.下列判断不正确的是( )
(2009?福建)控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如右图所示的原电池.下列判断不正确的是( )