题目内容
一定温度下的密闭容器中存在如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol?L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
(1)当CO转化率为25%时,该反应是否达到平衡,若未达到平衡,向哪个方向进行?
(2)达到平衡时,CO的转化率为多少?
(3)当CO的起始浓度仍为2mol?L-1,H2O(g)的起始浓度为6mol?L-1,求平衡时CO的转化率?
(1)当CO转化率为25%时,该反应是否达到平衡,若未达到平衡,向哪个方向进行?
(2)达到平衡时,CO的转化率为多少?
(3)当CO的起始浓度仍为2mol?L-1,H2O(g)的起始浓度为6mol?L-1,求平衡时CO的转化率?
分析:(1)根据化学反应进行到某个状态时的浓度熵和化学平衡常数之间的大小关系来回答;
(2)根据三行式计算化学反应中物质的转化率;
(3)根据三行式计算化学反应中物质的转化率.
(2)根据三行式计算化学反应中物质的转化率;
(3)根据三行式计算化学反应中物质的转化率.
解答:解:(1)当CO转化率为25%时,CO(g)+H2O(g)?CO2(g)+H2(g)
初始浓度:2 2 0 0
变化浓度:0.5 0.5 0.5 0.5
末态浓度:1.5 1.5 0.5 0.5
此时浓度熵Qc=
=
<1,所以不是平衡状态,化学反应会向正向进行.
答:不是平衡状态,会向正方向进行;
(2)设达到平衡时,CO的转化率为x
CO(g)+H2O(g)?CO2(g)+H2(g)
初始浓度:2 2 0 0
变化浓度:x x x x
末态浓度:2-x 2-x x x
则
=1,解得x=1,CO的转化率为
×100%=50%.
答:CO的转化率是50%;
(3)当CO的起始浓度仍为2mol?L-1,H2O(g)的起始浓度为6mol?L-1,设平衡时CO的转化率是x
CO(g)+H2O(g)?CO2(g)+H2(g)
初始浓度:2 6 0 0
变化浓度:x x x x
末态浓度:2-x 6-x x x
则
=1,解得x=1.5,所以CO的转化率为
×100%=75%.
答:平衡时CO的转化率为75%.
初始浓度:2 2 0 0
变化浓度:0.5 0.5 0.5 0.5
末态浓度:1.5 1.5 0.5 0.5
此时浓度熵Qc=
| 0.5×0.5 |
| 1.5×1.5 |
| 1 |
| 9 |
答:不是平衡状态,会向正方向进行;
(2)设达到平衡时,CO的转化率为x
CO(g)+H2O(g)?CO2(g)+H2(g)
初始浓度:2 2 0 0
变化浓度:x x x x
末态浓度:2-x 2-x x x
则
| x2 |
| (2-x)2 |
| 1 |
| 2 |
答:CO的转化率是50%;
(3)当CO的起始浓度仍为2mol?L-1,H2O(g)的起始浓度为6mol?L-1,设平衡时CO的转化率是x
CO(g)+H2O(g)?CO2(g)+H2(g)
初始浓度:2 6 0 0
变化浓度:x x x x
末态浓度:2-x 6-x x x
则
| x2 |
| (2-x)(6-x) |
| 1.5 |
| 2 |
答:平衡时CO的转化率为75%.
点评:本题涉及化学平衡常数以及转化率的计算知识,注意三行式的计算方法的应用是关键,难度不大.

练习册系列答案
相关题目
一定温度下的密闭容器中,不能表明A(s)+2B(g)?C(g)+D(g)已达平衡的是( )
| A、A的质量不再发生变化 | B、混合气体的总物质的量不再发生变化 | C、C的分子数目不再发生变化 | D、D的物质的量浓度不再发生变化 |
 H2CO3+OH-
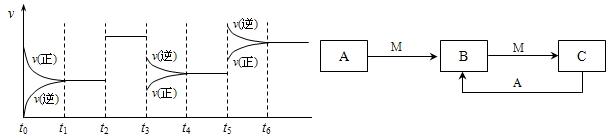
H2CO3+OH- 2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是