题目内容
下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)11种元素中,化学性质最不活泼的是________。
(2)①②⑤中,最高价氧化物对应的水化物碱性最强的是________。
(3)元素⑦的氢化物分子式为________,该氢化物与元素①的单质反应的离子方程式是_______________________________________________。
(4)①的最高价氧化物对应的水化物的化学式为__________。①和⑨两元素形成化合物的化学式为_________________________,该化合物灼烧时焰色为________,该化合物的溶液与元素⑧的单质反应的离子方程式为 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | | | | ⑥ | | ⑦ | bl | |
| 三 | ① | ③ | ⑤ | | | | ⑧ | ⑩ |
| 四 | ② | ④ | | | | | ⑨ | |
(2)①②⑤中,最高价氧化物对应的水化物碱性最强的是________。
(3)元素⑦的氢化物分子式为________,该氢化物与元素①的单质反应的离子方程式是_______________________________________________。
(4)①的最高价氧化物对应的水化物的化学式为__________。①和⑨两元素形成化合物的化学式为_________________________,该化合物灼烧时焰色为________,该化合物的溶液与元素⑧的单质反应的离子方程式为 。
(1)Ar (2)KOH (3)H2O 2K+2H2O===2K++2OH-+H2↑
(4)NaOH NaBr 黄色 Cl2+2Br-=2Cl-+Br2
(4)NaOH NaBr 黄色 Cl2+2Br-=2Cl-+Br2
试题分析:(1)稀有气体元素的最外层电子数已经达到稳定状态,所以化学性质最不活泼,因此化学性质最不活泼的是Ar元素。
(2)同周期自左向右金属性逐渐减弱,同主族自上而下金属性逐渐增强。金属性越强,最高价氧化物的水化物的碱性越强,则①②⑤中,最高价氧化物对应的水化物碱性最强的是KOH。
(3)⑦元素是氧元素,则其氢化物的化学式是H2O。K是活泼的碱金属,极易和水反应,生产氢氧化钾和氢气,反应的化学方程式是2K+2H2O=2KOH+H2↑。
(4)①是Na元素,其最高价氧化物对应的水化物的化学式为NaOH。⑨是Br元素,二者形成的化合物的化学式是NaBr,焰色反应显黄色。⑧是氯元素,氯元素的非金属性强于溴元素的,所以该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=2Cl-+Br2。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
相关题目
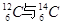 、②O2与O3、③正丁烷与异丁烷、④金刚石与石墨、⑤冰与水、⑥乙醇与二甲醚。请用序号填写对应的分类:(1)互为同位素的是 ;(2)互为同素异形体的是 ;(3)互为同分异构体的是 ;(4)属于同一化合物的是 。
、②O2与O3、③正丁烷与异丁烷、④金刚石与石墨、⑤冰与水、⑥乙醇与二甲醚。请用序号填写对应的分类:(1)互为同位素的是 ;(2)互为同素异形体的是 ;(3)互为同分异构体的是 ;(4)属于同一化合物的是 。