题目内容
(8分)往容积为10 L的密闭容器内通入40 mol N2和120 mol H2,在一定条件下进行反应,经2 s后达到平衡状态,平衡时c(N2)为2 mol/L。
(1)用H2的浓度变化表示2 s内的平均速率v(H2)=________。
(2)氮气的转化率是________。
(3)平衡时混合气体中氨的体积分数是________。
(4)容器内反应前后压强比是________。
(1)用H2的浓度变化表示2 s内的平均速率v(H2)=________。
(2)氮气的转化率是________。
(3)平衡时混合气体中氨的体积分数是________。
(4)容器内反应前后压强比是________。
(1)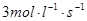 (2) 50% (3)33.3% (4)4:3
(2) 50% (3)33.3% (4)4:3
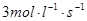 (2) 50% (3)33.3% (4)4:3
(2) 50% (3)33.3% (4)4:3平衡时氮气的浓度为2mol/L,物质的量为20mol,说明参加反应的氮气是4mol-2mol=2mol,则
_ N2 + 3H2 2NH3
2NH3
起始量(mol) 40 120 0
转化量(mol) 20 60 40
某时刻(mol) 20 60 40
所以用H2的浓度变化表示2 s内的平均速率v(H2)=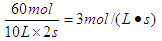
氮气的转化率是20÷20×100%=50%
平衡时混合气体中氨的体积分数是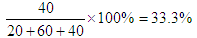
压强之比是物质的量之比
所以容器内反应前后压强比是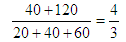
_ N2 + 3H2
 2NH3
2NH3起始量(mol) 40 120 0
转化量(mol) 20 60 40
某时刻(mol) 20 60 40
所以用H2的浓度变化表示2 s内的平均速率v(H2)=
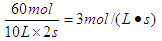
氮气的转化率是20÷20×100%=50%
平衡时混合气体中氨的体积分数是
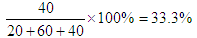
压强之比是物质的量之比
所以容器内反应前后压强比是
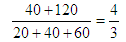

练习册系列答案
相关题目
 2NH3)在不同条件下达到平衡时混合物中氨的含量[起始时v(N2):v(H2)==1:3]。
2NH3)在不同条件下达到平衡时混合物中氨的含量[起始时v(N2):v(H2)==1:3]。 压强(MPa)
压强(MPa) 氨的含量
氨的含量 欲使平衡混合物中氨的含量为0.710,则选择的反应条件应为:
欲使平衡混合物中氨的含量为0.710,则选择的反应条件应为:  2NH3(g)+ 92.4 kJ。实验测得起始、平衡时的有关数据如下表:
2NH3(g)+ 92.4 kJ。实验测得起始、平衡时的有关数据如下表:
 bB(气) + cC(气), 在温度不变的条件下,再充入一定量的A物质, 重新达到平衡时, 下列判断中正确的是:( )
bB(气) + cC(气), 在温度不变的条件下,再充入一定量的A物质, 重新达到平衡时, 下列判断中正确的是:( ) cC(g) + dD(g) ΔH=Q;根据图回答:
cC(g) + dD(g) ΔH=Q;根据图回答: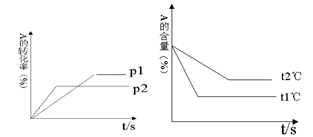
 2C(g)达到化学平衡状态的标志是
2C(g)达到化学平衡状态的标志是 3C(g),只有反应到达平衡时才具有的性质是( )
3C(g),只有反应到达平衡时才具有的性质是( )