题目内容
9.下列有关溶液中各类平衡的说法正确的是( )| A. | 加水稀释0.1mol•L-1 CH3COOH溶液时,溶液中所有离子浓度均减小 | |
| B. | 对FeCl3溶液进行稀释时,Fe3+的水解程度增大,故溶液的酸性增强 | |
| C. | 可根据难溶电解质Ksp的数值大小直接比较难溶电解质在水中的溶解度大小 | |
| D. | 25℃时,Ksp(AgCl)>Ksp(AgI),向AgCl悬浊液中加入KI固体,有黄色沉淀生成 |
分析 A、因为氢离子浓度会减小,而氢氧根离子的浓度是应该增大;
B、稀释促进水解,Fe3+的水解程度增大,氢离子浓度减小;
C、难溶电解质的组成不同;
D、沉淀向溶解度更小的转化.
解答 解:A、因为氢离子浓度会减小,酸性减弱,根据水的离子积常数可知,氢氧根离子的浓度是应该增大,故A错误;
B、稀释促进水解,Fe3+的水解程度增大,氢离子浓度减小,故溶液的酸性减弱,故B错误;
C、难溶电解质的组成不同,Ksp小,难溶电解质在水中的溶解度不一定小,故C错误;
D、25℃时,Ksp(AgCl)>Ksp(AgI),向AgCl悬浊液中加入KI固体,沉淀向溶解度更小的转化,故有黄色沉淀生成,故D正确;
故选D.
点评 弱电解质的电离是历年高考的重点,难度较大,考生在备考过程中应注意积累各个知识点的考查形式.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
20.以NA表示阿伏加德罗常数,下列说法错误的是( )
| A. | 30g甲醛和醋酸的混合物含NA个碳原子 | |
| B. | pH=1的硝酸溶液中有0.1NA个H+ | |
| C. | 3.9g钾完全转化为KO2时转移0.1NA个电子 | |
| D. | 1mol H2S有2NA个H-S键 |
18.下列离子方程式中书写正确的是( )
| A. | 在亚硫酸氢铵稀溶液中加入足量的氢氧化钠稀溶液NH4++H++2OH-=NH3•H2O+H2O | |
| B. | 等物质的量浓度、等体积的氢氧化钡溶液与明矾溶液混合3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓ | |
| C. | 氯化铁溶液中通入碘化氢气体2Fe3++2HI=2Fe2++I2+2H+ | |
| D. | 稀硝酸除银镜Ag+2H++NO3-=Ag++NO2↑+H2O |
19.下列说法正确的是( )
| A. | 分液、蒸馏、过滤和结晶等都是混合体系分离提纯常用的方法 | |
| B. | 检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 | |
| C. | 以下六种无色溶液:医用酒精、福尔马林、蚁酸溶液、乙酸溶液、葡萄糖溶液、稀硫酸,用新制Cu(OH)2悬浊液及简单的实验操作即可一一鉴别 | |
| D. | 淀粉与20%的硫酸混合溶液在沸水浴中充分加热后,冷却后滴加新制Cu(OH)2浊液,加热,无砖红色沉淀出现,说明淀粉未水解 |
 (R、R′代表烷基或H原子)发生缩合反应生成新的有机物和水.苯酚还能发生如下反应生成有机酸酯:
(R、R′代表烷基或H原子)发生缩合反应生成新的有机物和水.苯酚还能发生如下反应生成有机酸酯: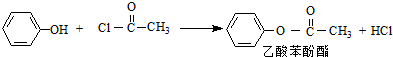

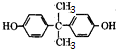 .
.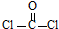 反应合成聚碳酸酯的化学方程式
反应合成聚碳酸酯的化学方程式 .
.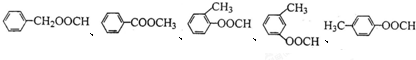 .
.
