题目内容
已知热化学方程式:①CO(g)+ O2(g)=CO2 (g) ΔH=--283.0kJ·mol-1
O2(g)=CO2 (g) ΔH=--283.0kJ·mol-1
②H2(g)+ O2 (g) =H2O(g) ΔH=--241.8 kJ·mol-1
O2 (g) =H2O(g) ΔH=--241.8 kJ·mol-1
则下列说法正确的是

A. H2的燃烧热为241.8kJ·mol-1
B. H2(g)转变成H2O(g)的化学反应一定要释放能量
C. 由反应①、②可知上图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
D. 根据②推知反应H2(g)+  O2(g)=H2O ΔH>-241.8 kJ·mol-1
O2(g)=H2O ΔH>-241.8 kJ·mol-1
练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
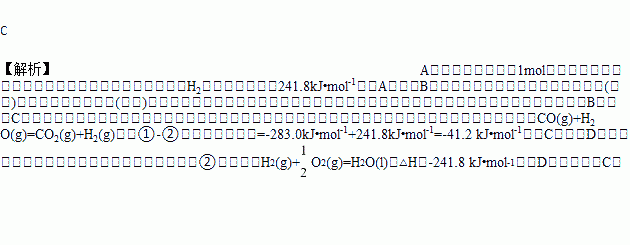

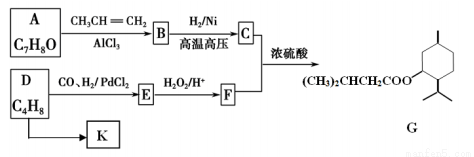
 RCH2CH2CHO
RCH2CH2CHO

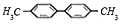 的一氯代物有5种
的一氯代物有5种
 2Z(g),有关下列图像的说法不正确的是
2Z(g),有关下列图像的说法不正确的是