题目内容
某混合物水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、CO32-、SO42-,现每次取100mL溶液分别进行下列实验:
| 实验编号 | 实验步骤 | 实验现象 |
| ① | 加入AgNO3溶液 | 有沉淀产生 |
| ② | 加入足量NaOH溶液后加热 | 收集气体0.896L(标准状况) |
| ③ | 加入足量的BaCl2 溶液 | 得到沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩余2.33g |
- A.c(K+)≥0.2 mol/L
- B.一定不存在的离子:Ca2+、K+、Cl-
- C.c(K+)+c(NH4+)=c(CO32-)+c(SO42-)
- D.一定存在的离子:Cl-、NH4+、CO32-、SO42-
A
分析:①加入AgNO3溶液,有沉淀产生,不能说明溶液中有Cl-;
②加入足量NaOH溶液后加热有气体生成,说明溶液中有NH4+,n(NH4+)=n(NH3)=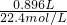 =0.04mol
=0.04mol
③加入足量BaCl2 溶液,得到沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩余2.33g,说明生成的沉淀能部分溶于盐酸,所以溶液中含有CO32-、SO42-,而不含Ca2+.
解答:AC.由②加入足量NaOH溶液后加热有气体生成,说明溶液中有NH4+,n(NH4+)=n(NH3)=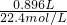 =0.04mol;
=0.04mol;
由③加入足量的BaCl2 溶液,得到沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩余2.33g,说明生成的沉淀能部分溶于盐酸,所以溶液中含有CO32-、SO42-,而不含 Ca2+;剩余2.33g是BaSO4,n(SO42- )=n(BaSO4)=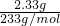 =0.01mol;BaCO3的质量为m(BaCO3)=6.27g-2.33g=3.94g,n(CO32-)=n(BaCO3)=
=0.01mol;BaCO3的质量为m(BaCO3)=6.27g-2.33g=3.94g,n(CO32-)=n(BaCO3)=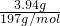 =0.02mol;
=0.02mol;
再由电荷守恒 c(K+)+c(NH4+)=2c(CO32-)+2c(SO42-),可知c(K+)=0.2 mol/L,但是不能确定有没有Cl-,所以c(K+)≥0.2 mol/L,故A正确,C错误;
BD.由①加入AgNO3溶液,有沉淀产生,不能说明溶液中有Cl-,因为CO32-、SO42-与AgNO3溶液也能生成沉淀,故B、D错误;
故选A.
点评:本题考查了溶液中离子的判断,电荷守恒在离子浓度求算时的应用,在写电荷守恒时要注意带多个电荷的离子.
分析:①加入AgNO3溶液,有沉淀产生,不能说明溶液中有Cl-;
②加入足量NaOH溶液后加热有气体生成,说明溶液中有NH4+,n(NH4+)=n(NH3)=
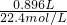 =0.04mol
=0.04mol③加入足量BaCl2 溶液,得到沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩余2.33g,说明生成的沉淀能部分溶于盐酸,所以溶液中含有CO32-、SO42-,而不含Ca2+.
解答:AC.由②加入足量NaOH溶液后加热有气体生成,说明溶液中有NH4+,n(NH4+)=n(NH3)=
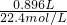 =0.04mol;
=0.04mol;由③加入足量的BaCl2 溶液,得到沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩余2.33g,说明生成的沉淀能部分溶于盐酸,所以溶液中含有CO32-、SO42-,而不含 Ca2+;剩余2.33g是BaSO4,n(SO42- )=n(BaSO4)=
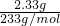 =0.01mol;BaCO3的质量为m(BaCO3)=6.27g-2.33g=3.94g,n(CO32-)=n(BaCO3)=
=0.01mol;BaCO3的质量为m(BaCO3)=6.27g-2.33g=3.94g,n(CO32-)=n(BaCO3)=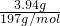 =0.02mol;
=0.02mol;再由电荷守恒 c(K+)+c(NH4+)=2c(CO32-)+2c(SO42-),可知c(K+)=0.2 mol/L,但是不能确定有没有Cl-,所以c(K+)≥0.2 mol/L,故A正确,C错误;
BD.由①加入AgNO3溶液,有沉淀产生,不能说明溶液中有Cl-,因为CO32-、SO42-与AgNO3溶液也能生成沉淀,故B、D错误;
故选A.
点评:本题考查了溶液中离子的判断,电荷守恒在离子浓度求算时的应用,在写电荷守恒时要注意带多个电荷的离子.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目