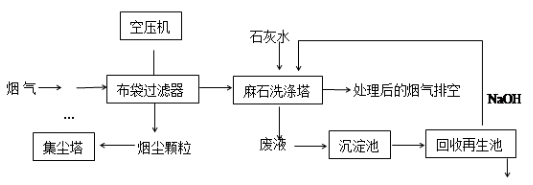
题目内容
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。
(1)含有较多 的水称为硬水,硬水加热后产生沉淀的离子方程式为____________(写出生成一种沉淀物的即可)。
(2)下图为某饮用水厂从天然水制备纯净水(去离子水)的工艺流程示意图:
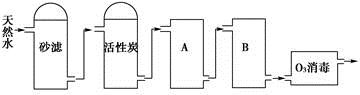
①活性炭的作用是____________;O3消毒的优点是___________。
②A、B中放置的物质名称分别是A_________;B__________。A、B中放置的物质是否可以互换?请说明原因__________。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留, 从而获得纯净水的方法称为 。电渗析法净化水时, 使离子通过半透膜的推动力是 。
(4)检验蒸馏水的纯度时, 最简单易行的方法是测定水的 。
(5)某城市用水中,c(Ca2+)为1.0×10-3mol/L, c(Mg2+)为5.0×10-4mol/L,c(HCO3-)为8.0×10-4mol/L。如用药剂软化该水1000L,应加入Ca(OH) 2 g, Na2CO3__________ g
(1)含有较多 的水称为硬水,硬水加热后产生沉淀的离子方程式为____________(写出生成一种沉淀物的即可)。
(2)下图为某饮用水厂从天然水制备纯净水(去离子水)的工艺流程示意图:

①活性炭的作用是____________;O3消毒的优点是___________。
②A、B中放置的物质名称分别是A_________;B__________。A、B中放置的物质是否可以互换?请说明原因__________。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留, 从而获得纯净水的方法称为 。电渗析法净化水时, 使离子通过半透膜的推动力是 。
(4)检验蒸馏水的纯度时, 最简单易行的方法是测定水的 。
(5)某城市用水中,c(Ca2+)为1.0×10-3mol/L, c(Mg2+)为5.0×10-4mol/L,c(HCO3-)为8.0×10-4mol/L。如用药剂软化该水1000L,应加入Ca(OH) 2 g, Na2CO3__________ g
(1)Ca2+、Mg2+ Ca2++ 2HCO3-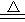 CaCO3↓+CO2↑+H2O(或Mg2++ 2HCO3-
CaCO3↓+CO2↑+H2O(或Mg2++ 2HCO3- MgCO3↓+CO2↑+H2O MgCO3+2H2O=Mg(OH)2+CO2↑+H2O)
MgCO3↓+CO2↑+H2O MgCO3+2H2O=Mg(OH)2+CO2↑+H2O)
(2) ①吸附水中的有机物(或去除水中的异味);反应产物无毒无害
②阳子交换树脂;阴离子交换树脂;水中的Ca2+ 、Mg2+会与阴离子树脂中的OH-生成Mg(OH)2、Ca(OH)2沉淀造成堵塞,损坏离子交换树脂。
(3)反渗透法;电势差或电场力
(4)电导率或电阻率
(5)66.6 116.6
 CaCO3↓+CO2↑+H2O(或Mg2++ 2HCO3-
CaCO3↓+CO2↑+H2O(或Mg2++ 2HCO3- MgCO3↓+CO2↑+H2O MgCO3+2H2O=Mg(OH)2+CO2↑+H2O)
MgCO3↓+CO2↑+H2O MgCO3+2H2O=Mg(OH)2+CO2↑+H2O)(2) ①吸附水中的有机物(或去除水中的异味);反应产物无毒无害
②阳子交换树脂;阴离子交换树脂;水中的Ca2+ 、Mg2+会与阴离子树脂中的OH-生成Mg(OH)2、Ca(OH)2沉淀造成堵塞,损坏离子交换树脂。
(3)反渗透法;电势差或电场力
(4)电导率或电阻率
(5)66.6 116.6
(1)含钙、镁离子较多的水为硬水,硬水加热后与碳酸氢根离子反应生成碳酸钙沉淀、碳酸镁沉淀或氢氧化镁沉淀。离子方程式为:
Ca2++2HCO3- CaCO3↓+CO2↑+H2O(或Mg2++2HCO3-
CaCO3↓+CO2↑+H2O(或Mg2++2HCO3- MgCO3↓+CO2↑+H2O MgCO3+2H2O=Mg(OH)2+CO2↑+H2O
MgCO3↓+CO2↑+H2O MgCO3+2H2O=Mg(OH)2+CO2↑+H2O
(2)①活性炭具有吸附性,其作用为吸附水中的有机物(或去除水中的异味),臭氧具有强氧化性,可用O3消毒,其优点是还原产物无毒。
②A、B的作用除去钙、镁离子,应先透过金属阳离子,则A为阳离子交换膜,B为阴离子交换膜,A、B不能放反,否则水中的Ca2+、Mg2+会与阴离子树脂中的OH-生成Mg(OH)2、Ca(OH)2沉淀造成堵塞,损坏离子交换树脂。
(3)压力使水分子通过半透膜而将大分子或离子截留,为反渗透法;电渗析法净化水时,电势差(或电场力)使离子通过半透膜。
(4)蒸馏水为纯水,其电导率很低,则检验蒸馏水的纯度时,最简单易行的方法是测定水的电导率或电阻率。
(5)c(Ca2+)=1.0×10-3mol/L,c(Mg2+)=5.0×10-4mol/L,c(HCO3-)=8.0×10-4mol/L.如用药剂软化该1000L,n(Ca2+)=1000L×1.0×10-3mol/L=1mol
,n(Mg2+)=1000L×5.0×10-4mol/L=0.5mol,
n(HCO3-)=1000L×8.0×10-4mol/L=0.8mol,加入氢氧化钙发生的反应为:
Mg2++2OH-=Mg(OH)2↓
0.5mol 1mol
HCO3-+OH-=CO32-+H2O
0.8mol 0.8mol
共需要n(OH-)=1.8mol则需要Ca(OH)2的质量为1.8mol×1/2×74g/mol=66.6g
水溶液中Ca2+物质的量为1mol+0.9mol=1.9mol,其中需要加入的碳酸根离子为1.9mol-0.8mol=1.1mol,其质量为1.1mol×106g/mol=116.6g。
Ca2++2HCO3-
 CaCO3↓+CO2↑+H2O(或Mg2++2HCO3-
CaCO3↓+CO2↑+H2O(或Mg2++2HCO3- MgCO3↓+CO2↑+H2O MgCO3+2H2O=Mg(OH)2+CO2↑+H2O
MgCO3↓+CO2↑+H2O MgCO3+2H2O=Mg(OH)2+CO2↑+H2O(2)①活性炭具有吸附性,其作用为吸附水中的有机物(或去除水中的异味),臭氧具有强氧化性,可用O3消毒,其优点是还原产物无毒。
②A、B的作用除去钙、镁离子,应先透过金属阳离子,则A为阳离子交换膜,B为阴离子交换膜,A、B不能放反,否则水中的Ca2+、Mg2+会与阴离子树脂中的OH-生成Mg(OH)2、Ca(OH)2沉淀造成堵塞,损坏离子交换树脂。
(3)压力使水分子通过半透膜而将大分子或离子截留,为反渗透法;电渗析法净化水时,电势差(或电场力)使离子通过半透膜。
(4)蒸馏水为纯水,其电导率很低,则检验蒸馏水的纯度时,最简单易行的方法是测定水的电导率或电阻率。
(5)c(Ca2+)=1.0×10-3mol/L,c(Mg2+)=5.0×10-4mol/L,c(HCO3-)=8.0×10-4mol/L.如用药剂软化该1000L,n(Ca2+)=1000L×1.0×10-3mol/L=1mol
,n(Mg2+)=1000L×5.0×10-4mol/L=0.5mol,
n(HCO3-)=1000L×8.0×10-4mol/L=0.8mol,加入氢氧化钙发生的反应为:
Mg2++2OH-=Mg(OH)2↓
0.5mol 1mol
HCO3-+OH-=CO32-+H2O
0.8mol 0.8mol
共需要n(OH-)=1.8mol则需要Ca(OH)2的质量为1.8mol×1/2×74g/mol=66.6g
水溶液中Ca2+物质的量为1mol+0.9mol=1.9mol,其中需要加入的碳酸根离子为1.9mol-0.8mol=1.1mol,其质量为1.1mol×106g/mol=116.6g。

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目