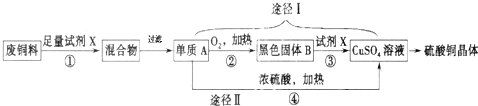
题目内容
3.下列液体均处于常温下(1)将pH=10和pH=12的NaOH溶液以1:2的体积比混合,则混合后所得溶液的pH约为11.7
(2)pH=6的H2SO4溶液加水稀释100倍,则溶液中H+与SO42-的浓度比等于20:1
(3)用pH=4,和pH=11的强酸和强碱混合,使pH=10,则两溶液的体积比V酸:V碱为9:2.
分析 (1)25℃时,KW=c(H+)•c(OH-)=10-7×10-7=10-14,两种碱溶液混合,先计算出混合后溶液的c(OH-),再根据溶液的Kw计算出溶液的c(H+),然后根据PH=-lg(c(H+)求PH值;
(2)依据pH=-lg[H+],计算pH=6的硫酸溶液中,氢离子的物质的量浓度,依据H2SO4=2H++SO42-,计算硫酸根离子的浓度;稀释100倍,此时溶液接近中性,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而稀释过程中硫酸根的物质的量不变,计算稀释后溶液中硫酸根的物质的量浓度,据此计算解答;
(3)pH=4的强酸溶液中c(H+)=10-4mol/L,pH=11的强碱溶液中c(OH-)=10-3mol/L,混合液的pH=10,则混合溶液中c(OH-)=10-4mol/L=$\frac{c(O{H}^{-}){•V}_{碱}-c({H}^{+})•{V}_{酸}}{{V}_{酸}+{V}_{碱}}$,据此计算酸碱体积之比.
解答 解:(1)25℃时,KW=c(H+)•c(OH-)=10-7×10-7=10-14,pH=10的NaOH溶液中c(OH-)=1×10-4mol/L,pH=12的NaOH溶液中c(OH-)=1×10-2mol/L,混合后c(OH-)=$\frac{1{0}^{-4}+1{0}^{-2}}{2}$mol/L≈$\frac{1{0}^{-2}}{2}$mol/L,
则溶液中的c(H+)=$\frac{1{0}^{-14}}{\frac{1{0}^{-2}}{2}}$mol/L=2.0×10-12mol/L,所以该溶液的pH=12-lg2=11.7,
故答案为:11.7;
(2)由pH=-lg[H+]可知pH=5的硫酸溶液中c(H+)=1×10-6mol/L,硫酸为强电解质完全电离,氢离子浓度为硫酸根离子浓度2倍,所以c(SO42-)=$\frac{1}{2}$c(H+)=$\frac{1}{2}$×1×10-6mol/L=5×10-7mol/L;
溶液稀释100倍后,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L;
硫酸根离子浓度为:c(SO42-)=5×10-7mol/L×$\frac{1}{100}$=5×10-9mol/L,
稀释后溶液中H+离子浓度与SO42-离子浓度比值约为:1×10-7mol/L:5×10-9mol/L:=20:1,
故答案为:20:1;
(3)pH=4的强酸溶液中c(H+)=10-4mol/L,pH=11的强碱溶液中c(OH-)=10-3mol/L,混合液的pH=10,即混合后显碱性:c(OH-)=10-4mol/L,
设强酸的体积为aL,强碱的体积为bL,
则有:混合溶液中c(OH-)=10-4mol/L=$\frac{c(O{H}^{-}){•V}_{碱}-c({H}^{+})•{V}_{酸}}{{V}_{酸}+{V}_{碱}}$=$\frac{1{0}^{-3}mol/L×bL-1{0}^{-4}mol/L×aL}{(a+b)L}$,解得a:b=9:2,
故答案为:9:2.
点评 本题考查了溶液酸碱性与溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握pH的概念及表达式,试题培养了学生的分析能力及化学计算能力.


| A. | 异嗪皮啶与白蜡树内酯互为同系物 | |
| B. | 白蜡树内酯在一定条件下可以发生水解、加成和取代反应 | |
| C. | 白蜡树内酯的分子式为C10H10O5 | |
| D. | 1mol异嗪皮啶最多可与5mol H2发生加成反应 |
| A. | $\frac{y-2x}{a}$mol•L-1 | B. | $\frac{y-x}{a}$mol•L-1 | C. | $\frac{2(y-x)}{a}$mol•L-1 | D. | $\frac{2(y-2x)}{a}$mol•L-1 |
 水杨酸甲酯又叫冬青油,是一种重要的有机合成原料.某化学小组用水杨酸(
水杨酸甲酯又叫冬青油,是一种重要的有机合成原料.某化学小组用水杨酸( )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.实验步骤:
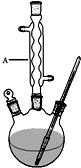
Ⅰ.如图,在三颈烧瓶中加入6.9g (0.05mol)水杨酸和24g(30mL,0.75mol)甲醇,向混合物中加入约10mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3 溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯4.5g.
常用物理常数:
| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
(1)仪器A的名称是球形冷凝管,制备水杨酸甲酯时,最合适的加热方法是水浴加热.
(2)反应结束后,分离甲醇的操作是蒸馏(或水洗分液).
(3)洗涤操作中,第一次水洗的主要目的是洗掉大部分的硫酸,第二次水洗的主要目的是洗掉碳酸氢钠.
(4)检验产品中是否含有水杨酸的化学方法是向产品中滴加少量的紫色石蕊试液,观察是否变红.
(5)本实验的产率为59%(保留两位有效数字).
| A. | 甲烷燃烧 | B. | 乙烯与溴水反应 | ||
| C. | 甲烷与氯气在光照下反应 | D. | 甲烷制炭黑 |
| A. | 氧气、干冰、硫酸、烧碱 | B. | 碘酒、冰、盐酸、烧碱 | ||
| C. | 氢气、二氧化硫、硝酸、纯碱 | D. | 铜、硫酸钠、醋酸、石灰水 |