题目内容
【题目】(1)在Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O反应中,请用双线桥法标出元素化合价的升降、电子得失和被氧化、被还原的情况。Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O反应中,请用双线桥法标出元素化合价的升降、电子得失和被氧化、被还原的情况。Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O______________ ;若参加反应Cu12.8克,则被还原H2SO4 _____摩尔。
CuSO4+SO2↑+2H2O______________ ;若参加反应Cu12.8克,则被还原H2SO4 _____摩尔。
(2)维生素C能使食物中的Fe3+转化为Fe2+,即Fe3+![]() Fe2+
Fe2+
①在此变化中,Fe3+被_____(填“氧化”或“还原”,下同),维生素C是_____剂。
②若有0.1 mol Fe3+转化为Fe2+,则维生素C_____(填“得”或“失”)_____mol电子。
【答案】 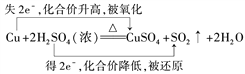 0.2 还原 还原 失 0.1
0.2 还原 还原 失 0.1
【解析】本题主要考查有关氧化还原反应的概念。
(1)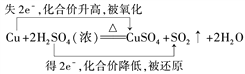 ;若参加反应的Cu12.8克即0.2mol,则被还原的H2SO40.2摩尔。
;若参加反应的Cu12.8克即0.2mol,则被还原的H2SO40.2摩尔。
(2)维生素C能使食物中的Fe3+转化为Fe2+,即Fe3+![]() Fe2+
Fe2+
①在此变化中,Fe3+化合价降低被还原,维生素C是还原剂。
②若有0.1molFe3+转化为Fe2+,得0.1mol电子,则维生素C失0.1mol电子。

练习册系列答案
相关题目