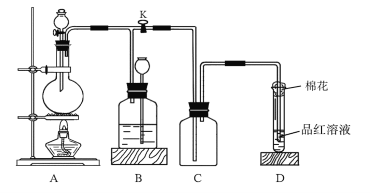
题目内容
【题目】镍是一种常用的有机催化剂,且在电磁领域应用广泛。某工厂以含镍废料(主要含NiO、Fe2O3、FeO、Al2O3、SiO2、CaO)为原料制备镍单质的流程如下:

已知:ⅰ.Ni2+在弱酸性环境中易水解,氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度);
ⅱ.常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Fe(OH)2]=8×10-16,Ksp[Al(OH)3]=1×10-33,Ksp[Ni(OH)2]=2×10-15,离子浓度低于1×10-5 mol·L-1时,认为沉淀完全。
回答下列问题:
(1)“粉碎”的目的是____________;“滤渣1”的主要成分为____________。
(2)“转化Ⅰ”的目的为___________________(用离子方程式表示)。
(3)为了更加环保,有人用H2O2代替NaClO进行“转化Ⅰ”,发现所用H2O2远远高于理论用量,分析造成这一结果的原因为__________________。
(4)调pH的目的是沉淀溶液中的铁和铝,调节pH=5时,________(选填“能”或“不能”)达到目的,“试剂X”可以是________(填选项字母)。
A.FeO B.Fe2O3 C.NiO D.Al2O3
(5)N2H4的电子式为___________;“转化Ⅱ”中发生反应的离子方程式为________。
(6)工业上也可取“滤液2”,利用电沉积法制取金属Ni,电解装置如下。电解过程中镍棒上可能发生的电极反应式为______________。

【答案】增大接触面积,加快酸溶速率 SiO2、CaSO4 2H++2Fe2++ClO-=2Fe3++Cl-+H2O 溶液中的Fe3+能催化分解H2O2,从而使所用H2O2远远高于理论用量 能 C ![]() 2Ni2++N2H4+4OH-=2Ni↓+N2↑+4H2O Ni2++2e-=Ni、2H++2e-= H2↑
2Ni2++N2H4+4OH-=2Ni↓+N2↑+4H2O Ni2++2e-=Ni、2H++2e-= H2↑
【解析】
向粉碎后的含镍废料中加入稀硫酸,其中的金属氧化物与硫酸反应产生NiSO4、Fe2(SO4)3、FeSO4、Al2(SO4)3、CaSO4,反应产生微溶于水的CaSO4 及不能反应的SiO2进入滤渣1中,向滤液中加入NaClO,溶液中Fe2+氧化为Fe3+,然后加入NiO调整溶液的pH,使溶液中的Fe3+、Al3+反应形成Fe(OH)3、Al(OH)3沉淀进入滤渣2中,在滤液2中含有Ni2+,向其中加入NaOH、N2H4,发生氧化还原反应产生N2、Ni和水,据此分析解答。
(1)“粉碎”含镍废料的目的是增大接触面积,可以加快酸溶速率;由上述分析可知,“滤渣1”的主要成分为SiO2、CaSO4;
(2)“转化Ⅰ”的目的是将溶液中Fe2+氧化为Fe3+,反应离子方程式为2H++2Fe2++ClO-=2Fe3++Cl-+H2O;
(3)用H2O2代替NaClO进行“转化Ⅰ”时,发现所用H2O2远远高于理论用量,这是由于溶液中生成的Fe3+能催化分解H2O2,使所用H2O2远远高于理论用量;
(4)根据Ksp[Fe(OH)3]=4×10-38、Ksp[Al(OH)3]=1×10-33可知,pH=5时c(Fe3+)=4×10-11 mol/L、c(Al3+)=1×10-6 mol/L,均小于1×10-5 mol/L,因此Fe3+、Al3+能沉淀完全;调pH时,为了使Fe3+、Al3+沉淀完全且不引入其他杂质,加入的“试剂X”可以是NiO,故合理选项是C;
(5)N2H4分子中两个N原子共用1对电子,每个N原子再分别与2个H原子形成2对共用电子对,所以N2H4的电子式为![]() ;“转化Ⅱ”中Ni2+与N2H4在碱性条件下发生氧化还原反应,产生Ni、N2、H2O,根据电子守恒、电荷守恒及原子守恒,可得反应的离子方程式为2Ni2++N2H4+4OH-=2Ni↓+N2↑+4H2O。
;“转化Ⅱ”中Ni2+与N2H4在碱性条件下发生氧化还原反应,产生Ni、N2、H2O,根据电子守恒、电荷守恒及原子守恒,可得反应的离子方程式为2Ni2++N2H4+4OH-=2Ni↓+N2↑+4H2O。
(6)电解过程中Ni2+在阴极镍棒上获得电子,发生还原反应,还可能有溶液中的H+获得电子变为H2逸出,故电解过程中镍棒上可能发生的电极反应式为Ni2++2e-=Ni和2H++2e-= H2↑。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】下列根据实验操作和现象所得出的结论错误的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X不一定含有SO42- |
B | 向FeCl3+3KSCN | 体系颜色无变化 | KCl不能使该平衡移动 |
C | 向浓度均为0.1mol·L-1NaOH和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
D | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
A.AB.BC.CD.D