题目内容
(12分)多重平衡规则在未知电位的计算中起着非常重要的作用,请利用该规则完成下列问题。
1.已知:NO3-+3H++2e-=HNO2+H2O;E1θ=0.93V,Ka(HNO2)=4.6×10-4。
求:NO3-+H2O+2e-=NO2-+2OH-的E2θ值。
2.已知:a.Mg(s)+1/2O2(g)=MgO(s) ΔrG![]() =-569.44kJ/mol
=-569.44kJ/mol
b.MgO(s)+H2O(e)=Mg(OH)2(s) ΔrG![]() =-26.95kJ/mol
=-26.95kJ/mol
c.H2O(1)=H2(g)+1/2O2(g) ΔrG![]() =237.19kJ/mol
=237.19kJ/mol
d.H2O(1)![]() H+(aq)+OH-(aq) Kw=1.0×10-14
H+(aq)+OH-(aq) Kw=1.0×10-14
e.Mg(OH)2(s)=Mg2+(aq)+2OH-(aq) Ksp=5.61×10-12
求:Mg2+(aq)+2e-=Mg(s)的Eθ值。
1.a.NO3-+3H++2e-=HNO2+H2O ![]() =0.93V
=0.93V
b.HNO2![]() H++NO2- Ka=4.6×10-4
H++NO2- Ka=4.6×10-4
c.2H2O![]() 2H++2OH- K=Kw2
2H++2OH- K=Kw2
将半反应a与标准氢电极组成原电池反应:d.NO3-+3H++H2=HNO2+H2O+2H+ ΔE=0.93V
反应d:lgK=2×0.93/0.059 1
b+c+d:NO3-+H2O+H2=NO2-+2OH-+2H+ (e)
lgKe=1gKa+1gKw2+2×0.93/0.059 1=0.135
ΔE=![]() -0.00=0.059 1×0.135/2=0.004 0(V)
-0.00=0.059 1×0.135/2=0.004 0(V) ![]() =0.004 0(V)(6分)
=0.004 0(V)(6分)
2.a+b+c+e-2d:Mg(s)+2H+(aq)=Mg2+(aq)+H2(g)
![]() =-454.75(kJ/mol)
=-454.75(kJ/mol)
ΔE=0.00-![]() =
=![]() =2.36(V)
=2.36(V)
故![]() =-2.36V(6分)
=-2.36V(6分)

 金牌教辅培优优选卷期末冲刺100分系列答案
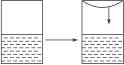
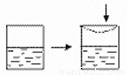
金牌教辅培优优选卷期末冲刺100分系列答案 (2011?上海模拟)在体积可变的密闭容器中建立氨气在水中的溶解平衡和电离平衡,在如图的容器中按图示操作,下列各项叙述正确的是?( )
(2011?上海模拟)在体积可变的密闭容器中建立氨气在水中的溶解平衡和电离平衡,在如图的容器中按图示操作,下列各项叙述正确的是?( )