题目内容
氯酸是一种强酸,氯酸的浓度超过40%就会迅速分解,产生比它的酸性更强的含氧酸(HClO4),同时放出两种单质气体。该气体混合物经干燥后,平均相对分子质量为47.6,它可以使带火星的木条复燃,并可以使湿润的淀粉碘化钾试纸变蓝后褪色。试完成以下各题:(1)定量推算该气体混合物的组成。
(2)写出氯酸分解的化学方程式并配平。
(3)写出该气体混合物与湿润的淀粉碘化钾试纸作用的化学方程式并配平。
(4)将该气体混合物通过80℃NaOH溶液会发生什么反应?写出化学方程式并配平。
(1)氯酸分解产生比它的酸性更强的含氧酸是高氯酸(HClO4),生成的可以使带火星的木条复燃的气体是O2,生成的可以使湿润的淀粉碘化钾试纸变蓝后褪色的气体是Cl2。生成的氧气和氯气的平均相对分子质量为47.6,由此可以计算生成的氧气和氯气的物质的量之比。
设氧气和氯气组成的混合气体中,氧气的物质的量分数为x,氯气的物质的量分数为(1-x),则:32x+71(1-x)=47.6,解得:x∶(1-x)=3∶2,即氧气和氯气的物质的量之比为3∶2。
(2)根据氧化还原反应过程中得失电子守恒可以确定HClO4的化学计量数。由解析(1)及题意可知,氯酸分解的化学方程式为:(a+4)HClO3=aHClO4+3O2↑+2Cl2↑+2H2O,根据得失电子守恒有:a×2+2×2×3=5×2×2,得a=4。因此配平的化学方程式为:8HClO3=4HClO4+3O2↑+2Cl2↑+2H2O。
(3)该气体混合物与湿润的淀粉碘化钾试纸作用的化学方程式分别为:Cl2+2KI=2KCl+I2,5Cl2+I2+6H2O=2HIO3+10HCl。
(4)将该气体混合物通过80℃NaOH溶液,这时Cl2与热的烧碱溶液发生反应:3Cl2+6NaOH
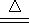 5NaCl+NaClO3+3H2O。
5NaCl+NaClO3+3H2O。【试题分析】

练习册系列答案
相关题目