题目内容
(包括2小题,满分共10分)
Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是_______________________(可以多选)
A.用pH试纸测定Na2CO3溶液的pH
B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
C.实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
D.配制一定物质的量浓度的氯化钠溶液
E.取某溶液做焰色反应实验,说明该溶液中含有钠元素
F.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
G.促使过饱和的硝酸钾溶液析出晶体
H.用倾析法进行分离、洗涤颗粒较大的沉淀
Ⅱ.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:

⑴写出电解时发生反应的化学方程式: ;
⑵除去ClO2中的NH3可选用的试剂是 ;(填序号)
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水
⑶测定ClO2(如右图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I- +S4O62-),共用去VmL硫代硫酸钠溶液。①装置中玻璃液封管的作用是 ;
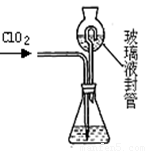
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式 ;
③测得ClO2的质量m(ClO2)= 。(用含c、V的代数式表示)
Ⅰ.CE(2分)
Ⅱ.⑴NH4Cl+2HCl 3H2↑+NCl3(2分)
3H2↑+NCl3(2分)
⑵ C(1分)
⑶①吸收残余的二氧化氯气体,并使锥形瓶内外压强相等(1分)
②2ClO2+10I-+8H+=4H2O+5I2+2Cl-(2分)
③1.35cv×10-2g(2分)
【解析】Ⅰ.A中测定pH需要用玻璃棒蘸取待测液。B中需要经过过滤、洗涤、蒸发浓缩结晶,需要玻璃棒。C中需要长滴管。D中需要溶解和转移需要玻璃棒。E中需要铂丝。F浓硫酸的脱水实验,需要玻璃棒搅拌。G中需要玻璃棒搅拌。H中需要玻璃棒转移固体颗粒。
Ⅱ.(1)根据电解时物质的变化可看出,阴极氢离子放电,生成氢气。阳极NH4+放电,生成NCl3。
(2)依据ClO2的性质易溶于水,并结合氨气是碱性气体,可得出用浓硫酸除杂。
(3)ClO2有毒,需要进行尾气处理,同时也为了平衡内外压强,使气体容易被吸收。根据反应2ClO2+10I-+8H+=4H2O+5I2+2Cl-、I2+2S2O32-=2I- +S4O62-,可知ClO2和S2O32-是1︰5的关系,所以ClO2的物质的量是0.0002Vcmol,其质量是1.35cv×10-2g.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案




