题目内容
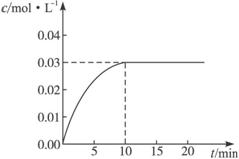
在某一容积为5 L的密闭容器内,加入0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g)
ΔH>0,反应中CO2的浓度随时间变化情况如右图:
CO2(g)+H2(g)
ΔH>0,反应中CO2的浓度随时间变化情况如右图:

(1)根据图上数据,反应开始至达到平衡时,
CO的化学反应速率为v(CO)= mol/(L·min)-1,
该温度下的平衡常数K= 。
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有
(填字母)
A.升高温度 B.降低温度 C.增大压强 D.减小压强
E.加入催化剂 G.移出一氧化碳气体
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=________________mol/L.
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,CO的转化率_______(填“升高”、“降低”还是“不变”),CO2的质量分数________(填“升高”、“降低”还是“不变”).
(5)在催化剂存在和800℃的条件下,在某一时刻测得C(CO)=C(H2O)= 0.09mol/L,
C(CO2 )=C(H2)=0.13mol/L ,则此反应是否处于平衡状态: (填“是”或“否”),若没有处于平衡状态则该反应向 移动。(填“正方向”或“逆方向”)
(1)0.003 1 (2)A (3)0.03 (4)升高 降低 (5)否 逆方向
【解析】
试题分析:(1)平衡时CO2浓度为0.03mol/L,v(CO2)=v(CO)= ="0.003" mol/(L·min)-1。平衡时c(CO)=c(H2O)=0.03mol/L,c(CO2)=c(H2)=0.03mol/L,K=
="0.003" mol/(L·min)-1。平衡时c(CO)=c(H2O)=0.03mol/L,c(CO2)=c(H2)=0.03mol/L,K=  =1。
=1。
(2)平衡常数只与温度有关。该反应是吸热反应,升高温度,平衡向右移动,K增大。
(3) =
= >K,反应向左进行。设平衡时c(CO)=(x+0.02)mol/L,则平衡时c(H2O)=(x+0.02)mol/L,c(CO2)=c(H2)=(0.04-x)mol/L,由K=1得x=0.01。
>K,反应向左进行。设平衡时c(CO)=(x+0.02)mol/L,则平衡时c(H2O)=(x+0.02)mol/L,c(CO2)=c(H2)=(0.04-x)mol/L,由K=1得x=0.01。
(4)向(1)平衡体系中再充水蒸气,CO转化率升高。(1)平衡时CO2质量分数=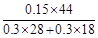 =0.478。若起始时充入0.3molCO和0.6molH2O,由平衡常数不变得平衡时CO2为0.2mol,质量分数为
=0.478。若起始时充入0.3molCO和0.6molH2O,由平衡常数不变得平衡时CO2为0.2mol,质量分数为 =0.415。
=0.415。
(5) =
=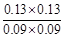 >K=1,反应向逆反应方向进行。
>K=1,反应向逆反应方向进行。
考点:化学反应速率 化学平衡常数 勒沙特列原理 化学反应进行的方向
点评:用平衡常数判断反应进行的方向的方法:某时刻反应物浓度商Q=K,反应是平衡状态;Q>K,反应向逆反应方向进行;Q<K,反应向正反应方向进行。

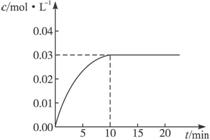
在某一容积为5 L的密闭容器内,加入0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) 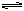 CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图: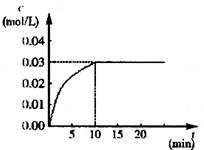
(1)根据图上数据,反应开始至达到平衡时,
CO的化学反应速率为v(CO)= mol/(L·min)-1,
该温度下的平衡常数K= 。
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有
(填字母)
| A.升高温度 | B.降低温度 | C.增大压强 | D.减小压强 |
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=________________mol/L.
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,CO的转化率_______(填“升高”、“降低”还是“不变”),CO2的质量分数________(填“升高”、“降低”还是“不变”).
(5)在催化剂存在和800℃的条件下,在某一时刻测得C(CO)=C(H2O)= 0.09mol/L,
C(CO2 )=C(H2)=0.13mol/L ,则此反应是否处于平衡状态: (填“是”或“否”),若没有处于平衡状态则该反应向 移动。(填“正方向”或“逆方向”)