题目内容
某有机物样品3.1g完全燃烧,燃烧后的混合物通入过量的澄清的石灰水,石灰水共增重7.1g,经过滤得到10g沉淀。还有机物样品可能是
| A.乙醇 | B.乙二醇 | C.甲醇 | D.甘油 |
B
试题分析:根据题意,l0g沉淀为CaCO3,即产生的二氧化碳为0.1mol,质量是4.4g,其中碳元素质量为:0.1mol×12g/mol=1.2g,即n(C)=0.1mol。石灰水增重7.1g,所以有机物燃烧生成的水的质量为:7.1g-4.4g=2.7g,则n(H)=
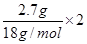 =0.3mol,氢元素质量为0.3mol×1g/mol=0.3g,有机样品共3.1g,所以O元素物质的质量=3.1g-1.2g-0.3g=1.6g,物质的量为1.6g÷16g/mol=0.1mol,则碳、氢、氧原子的物质的量之比为1:3:1,即最简式为CH3O,只有B符合,答案选B。
=0.3mol,氢元素质量为0.3mol×1g/mol=0.3g,有机样品共3.1g,所以O元素物质的质量=3.1g-1.2g-0.3g=1.6g,物质的量为1.6g÷16g/mol=0.1mol,则碳、氢、氧原子的物质的量之比为1:3:1,即最简式为CH3O,只有B符合,答案选B。点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生解题的培养。根据燃烧法确定有机物的分子式依据是:有机物中的碳全部转化为二氧化碳,有机物中的氢全部转化为水,根据原子守恒和质量守恒思想来解决。

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目

