题目内容
实验室常以纯净的无水Na2CO3作基准物,用未知浓度的盐酸滴定之,通过此法来测定盐酸的准确浓度.下列判断正确的是
[ ]
A.若所取Na2CO3在空气中受过潮,则被测盐酸浓度偏高
B.若称量Na2CO3天平的砝码上沾有污物,则被测盐酸浓度偏高
C.盛放盐酸的滴定管玻璃活塞下端有气泡,滴定过程中气泡被液流冲出,则被测盐酸浓度偏高
D.滴定前,滴定管里的溶液仰视读数;滴定后,滴定管里的溶液俯视读数,则被测盐酸浓度偏高
解析:
|
【巧解导析】要做好这道题,首先应明白该滴定的原理: 2HCl+Na2CO3 设所称取的Na2CO3质量为m g,所消耗盐酸的体积为V,盐酸的物质的量浓度为c,则它们之间的量的关系可由方程式得出: V·c=2× 再以该计算式对A,B,C,D各项进行判断: A项:若Na2CO3在空气中受潮,则会变成带结晶水的晶体,例如生成Na2CO3·10H2O晶体,则称量时虽然固体质量不变,但由于固体中含结晶水,故实际消耗的盐酸的体积变小,由上述分析知被测盐酸浓度偏高. B项:若砝码上有污染,则砝码的实际质量等于砝码标定质量加上污染质量,由天平称量原理知,所称得的Na2CO3的质量大于砝码标定质量,故实际滴定过程中消耗的盐酸的体积变大(Na2CO3质量在计算时依然等于砝码标定质量),因而由上述计算式知所测定的盐酸浓度偏低. C项:由于滴定前滴定管玻璃活塞下端有气泡(空气),其中空气会占据一定体积,在滴定过程中空气被赶走,其空间被盐酸溶液占据,这部分盐酸并没有滴到锥形瓶中参与反应,但它的体积依然由滴定管读出,即实际测得的盐酸体积变大,由上述分析式知被测盐酸浓度偏低. D项:由滴定管的结构知:小刻度在上,大刻度在下,仰视使读数偏大,俯视使读数偏小,而所消耗的体积V=V2-V1,故实际消耗的盐酸体积大于所读出的盐酸体积,即盐酸体积变小,所测盐酸浓度偏高. |
提示:
|
【巧解点悟】解题关键点是要明白滴定原理,明白测定值(Na2CO3质量及盐酸体积)与计算所用值之间的关系.解题易错点为:若不清楚滴定管的结构及天平的称量原理,易误选B,C. |

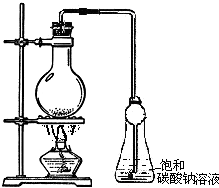 实验室用乙酸和乙醇在浓硫酸作用下反应制备乙酸乙酯,反应装置如右图:
实验室用乙酸和乙醇在浓硫酸作用下反应制备乙酸乙酯,反应装置如右图:已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH;②部分有机物的沸点如下:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.5 | 78.5 | 117.9 | 77 |
(1)写出制备乙酸乙酯的化学方程式
(2)浓硫酸的作用是
(3)用如图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为
(4)实验所得到的乙酸乙酯中常含有一定量的乙醇、乙醚和水,先加入无水氯化钙后过滤,可除去
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/ | 34 | 78.5 | 118 | 77 |
(1)浓硫酸的作用是
(2)球形干燥管C的作用是
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出
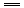 2NaCl+CO2↑+H2O
2NaCl+CO2↑+H2O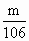 ,即c=
,即c=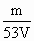 .
.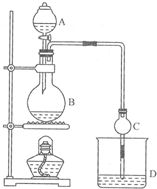 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液. 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.