题目内容
“碘钟”实验中,![]() 的反应速率可以用
的反应速率可以用![]() 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/ mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c( | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
回答下列问题:
(1)该实验的目的是___________________________________。
(2)显色时间t1=______________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为______(填字母)。
(A)<22.0 s (B)22.0 s~44.0 s (C)>44.0 s (D)数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是______________________________。
(1)研究反应物I-与S2O82-的浓度对反应速率的影响 (2)29.3s (3)A (4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)
解析:
由题目中表格数据可分析出c(I-)、 c(S2O82-)浓度越大,反应速率越快,显蓝色所需时间越少,故实验目的应是研究反应物I-与S2O82-的浓度对反应速率的影响,因反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比),由①⑤中数据可列关系:显色时间t2=0.040??0.040??88.0/0.120??0.040=29.3 s,升高温度,反应速率加快,故显色时间t2<22.0s。
【标签】化学反应速率

 名校课堂系列答案
名校课堂系列答案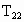 )“碘钟”实验中,
)“碘钟”实验中,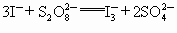 的反应速率可以用
的反应速率可以用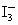 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如表2-3-2:
与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如表2-3-2: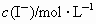
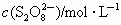
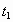
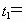 。
。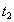 的范围为 (填字母)。
的范围为 (填字母)。