题目内容
18.为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如图所示.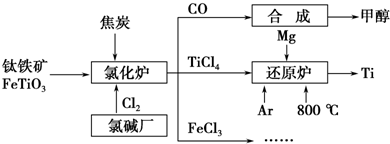
请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用:增大反应物间接触面积,提高反应速率
(2)已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7:6,则氯化炉中化学方程式为2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO其中还原剂是C、FeTiO3.
(3)Ar气通入还原炉中并不参与反应,通入Ar气的作用是:Mg和Ti都有强还原性,在Ar气氛围中可防止被氧化
(4)向FeCl3溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=2.7×10-3[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(5)欲用FeCl3固体配制稀的FeCl3溶液,请简述操作步骤将氯化铁固体溶于较浓的盐酸,然后再加水稀释.
分析 (1)粉碎反应物,可以增大其表面积,从而提高反应速率;
(2)根据“氯化炉中反应氯气和焦炭的理论用料物质的量比为7:6”写出反应的化学方程式,还原剂在反应中化合价升高、被氧化,然后根据化合价变化情况判断还原剂;
(3)根据氩气性质不活泼及Mg和Ti等具有强还原性易被氧化方面考虑;
(4)当两种沉淀共存时,Ag+离子浓度相同,根据溶度积常数可得:c(Br-)=$\frac{{K}_{sp}(AgBr)}{c(A{g}^{+})}$,c(Cl-)=$\frac{{K}_{sp}(AgCl)}{c(A{g}^{+})}$,据此计算出$\frac{c(B{r}^{-})}{c(C{l}^{-})}$;
(5)铁离子易水解,所以在配制氯化铁溶液时常将FeCl3固体先溶于较浓的盐酸中,然后再加水稀释.
解答 解:(1)粉碎反应物,可以增大其表面积,从而增大反应物之间的接触面积,提高反应速率,
故答案为:增大反应物间接触面积,提高反应速率;
(2)已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7:6,则发生的反应为:2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO,根据化合价变化可知,C和FeTiO3为还原剂,
故答案为:2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO;C、FeTiO3;
(3)氩气性质不活泼可以防止Mg和Ti等具有强还原性的物质被氧化,
故答案为:Mg和Ti都有强还原性,在Ar气氛围中可防止被氧化;
(4)当两种沉淀共存时,Ag+离子浓度相同,根据溶度积常数计算,c(Br-)=$\frac{{K}_{sp}(AgBr)}{c(A{g}^{+})}$,c(Cl-)=$\frac{{K}_{sp}(AgCl)}{c(A{g}^{+})}$,则$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=$\frac{5.4×1{0}^{-3}}{2.0×1{0}^{-10}}$=2.7×10-3,
故答案为:2.7×10-3;
(5)FeCl3为强酸弱碱盐,铁离子水解而使其溶液呈酸性,水解离子反应方程式为Fe3++3H2O?Fe(OH)3+3H+,根据方程式知,为防止铁离子水解,在配制氯化铁溶液时常将FeCl3固体先溶于较浓的盐酸中,氢离子浓度增大,从而抑制铁离子水解,然后再加水稀释,
故答案为:将氯化铁固体溶于较浓的盐酸,然后再加水稀释.
点评 本题考查了难溶电解质的溶解平衡的计算、盐的水解原理的应用、化学方程式书写等知识,题目难度中等,试题知识点较多,充分考查学生的分析、理解能力及灵活应用基础知识的能力.

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案| A. | 适当升高温度 | B. | 将锌粒改为锌粉 | ||
| C. | 将所用硫酸加适量水适当稀释 | D. | 寻找一种合适的催化剂并加入其中 |
| A. | 钠放在空气中易被氧气氧化为过氧化钠,因此应保存在水面下 | |
| B. | 钠是强还原剂,它能从水溶液中置换出金属活动顺序表中钠后面的金属 | |
| C. | 钠蒸气充入灯泡中制成钠灯,常用于航海灯塔照明 | |
| D. | 金属钠着火时,能用水来灭火 |
| A. | 分馏石油得到的各个馏分都是纯净物 | |
| B. | 石油的裂解是为了提高汽油等轻质油的产量和质量 | |
| C. | 煤中含有苯、甲苯、二甲苯等有机化合物 | |
| D. | 不沾锅的表面涂覆的聚四氟乙烯是一种有机高分子材料 |
| A. | 化学反应能够制造出新的物质,同时也能制造出新的元素 | |
| B. | 化合反应不一定为氧化还原反应 | |
| C. | 化学反应必然伴随着能量的变化 | |
| D. | 海水中含有钾元素,经过物理变化和化学反应可以得到钾单质 |
| A. | 0.5(a+b)mol | B. | 0.5(a-b)mol | C. | (a-b)mol | D. | (a+b)mol |
| A. | 绿色化学的核心就是如何对被污染的环境进行无毒、无害化的治理 | |
| B. | 海水化学资源丰富,利用蒸馏的方法可以获得NaCl、Br2和Mg等物质 | |
| C. | 人类目前所直接利用的能量大部分是由化学反应产生的 | |
| D. | 动物体内葡萄糖被氧化成H2O、CO2的同时,伴随着热能转变成化学能 |
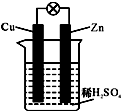
| A. | 锌极是正极 | B. | 铜片上有气泡产生 | ||
| C. | 电子经外电路从铜片流向锌片 | D. | 该装置是将电能转化为化学能 |