题目内容
【题目】I.一定量的液态化合物XY2,在一定量的氧气中恰好完全燃烧,其化学方程式:XY2(l)+3O2(g)![]() XO2(g)+2YO2(g) (l代表液体,g代表气体)
XO2(g)+2YO2(g) (l代表液体,g代表气体)
冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56 g·L-1。
(1)观察反应前后气体的化学计量数,可得反应前氧气的体积是__________。
(2)化合物XY2的摩尔质量是__________。
(3)若XY2分子中X、Y两元素质量比是3:16,则X、Y两元素分别为__________和__________(填元素符号)。
II.常温下,将20.0 g质量分数为14.0 %的KNO3溶液跟30.0 g质量分数为24.0 %的KNO3溶液混合,得到密度为1.15 gcm﹣3的混合溶液。计算:
(1)混合后溶液的质量分数___________。
(2)混合后溶液的物质的量浓度____________(保留一位小数)。
【答案】672 mL76 g·mol-1CS20 %2.3 mol·L-1
【解析】
生成物总物质的量为n(XO2)+n(YO2)=0.672L÷22.4L/mol=0.03mol,由方程式可知,n(XO2):n(YO2)=1:2,则n(XO2)=0.01mo, n(YO2)=0.02mol.
I.(1)观察反应前后气体的化学计量数,可得反应前氧气的体积与反应生成物总体积相等,在标准状况下测得生成物的体积是672 mL,所以反应前氧气的体积为672 mL;
(2)根据质量守恒得出,产物的总质量为m(XO2)+m(YO2)=0.672L×2.56 g·L-1=1.72g,又根据方程式计量数对应关系得出n(XY2)=0.01mol,n(O2)=0.03mol, m(O2)=0.03mol×32g/mol=0.96g,根据质量守恒可知m(XY2)= 1.72g-0.96g=0.76g,根据M=m/n得出,M(XY2)=0.76g÷0.01mol=76g/mol。
(3)由在XY2分子中,X、Y两元素的质量之比为3:16得出:1mol XY2分子中,X的质量为76g×3/19=12g ,Y的质量为76g-12g=64g ,1mol XY2含有1mol X,2mol Y,故X的相对原子质量是12,Y的相对原子质量是64/2=32,即X是C,Y是S。
II.(1) 20.0 g质量分数为14.0 %的KNO3的溶液中溶质的质量m1=20.0 g×14.0 %=2.8g; 30.0 g质量分数为24.0 %的KNO3溶液溶质的质量m2=30.0 g×24.0 %=7.2g ,溶液混合前后溶质、溶液的质量都不变,所以混合液的质量分数为(2.8g+7.2g)/(20g+30g)×100%=20%。
(2)混合液中溶质的质量为2.8g+7.2g=10g,溶质的物质的量为n=10g÷101g/mol=10/101mol,
溶液的体积为(20g+30g)÷1.15g/Ml=1/23L,所以溶液的物质的量浓度为c=10/101mol ÷1/23L=2.3mol/L。

【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
水中的溶解性 | 可溶于冷水,易溶于热水 | 可溶 | 易溶 | 易溶 |
乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
实验流程如下:
请回答下列问题:(1)第①步中溴水氧化葡萄糖时,下列装置最合适的是________。
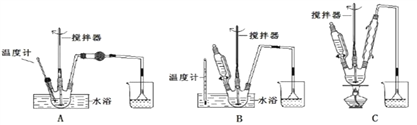
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是________。
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是________;本实验中不宜用CaCl2替代CaCO3,理由是________。
(3)第③步需趁热过滤,其原因是________。
(4)第④步加入乙醇的作用是________。
第⑥步中,下列洗涤剂最合适的是________。
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液