题目内容
(1)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体类型为 。
(2)①CH2=CH2、②CH≡CH、③  、④CH3—CH3这四种分子中碳原子采取sp2杂化的是 (填序号)。
、④CH3—CH3这四种分子中碳原子采取sp2杂化的是 (填序号)。

(3)如图为某晶体的一个晶胞示意图,该晶体由A、B、C三种基本粒子组成,则该晶体的化学式为 。
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。实验室制取氯气除了用浓盐酸和二氧化锰反应外还可利用下列反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热。请你根据所学知识回答下列问题:
(1)上述反应中 是氧化剂,该反应中氧化产物与还原产物的物质量之比为 。
(2)把氯气通入紫色石蕊溶液中,可以观察到的现象是: 。
(3)实验室配制好2.0 mol·L-1的NaOH溶液,需要这种溶液 mL才能与2.24 L氯气(标准状况)恰好完全反应。
(4)已知Br2的水溶液因浓度不同而呈现橙色或红棕色,NaBr溶液中缓缓通入Cl2时,可以看到无色溶液逐渐变为红棕色,请写出对应的离子方程式并用双线桥法表示出电子转移情况: 。
(5)现需490 mL 2.0 mol·L-1NaOH溶液:
①所需称量的氢氧化钠固体的质量是 。
②上述实验需要的仪器有天平(含砝码)、药匙、烧杯、量筒、玻璃棒、胶头滴管、 。
③在配制溶液的过程中,下列操作可能造成结果偏高的是 。
A.定容时俯视 |
B.容量瓶不干燥,含有少量蒸馏水 |
C.溶解所用烧杯未洗涤 |
D.NaOH溶解后,未冷却即进行实验 |
已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表。
元素 | 结构或性质信息 |
X | 原子的L层上s电子数等于p电子数 |
Y | 原子核外的L层有3个未成对电子 |
Z | 地壳中含量最多的元素 |
Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
R | 核电荷数是Y与Q的核电荷数之和 |
E | N能层上只有一个电子,K、L、M层均排满电子 |
请根据信息回答有关问题:
(1)写出元素Y的原子核外价电子排布图: 。X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为 。
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号) 。
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式) ,原因是 。
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式: 。
(5)R的一种配合物的化学式为RCl3·6H2O。已知0.01 mol RCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是 。
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2·H2O
C.[R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O
(6)向含少量ESO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,反应的离子方程式为: ,继续滴加氨水至过量,沉淀溶解,得到天蓝色溶液,写反应的离子方程式为: 。
(7)元素E的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
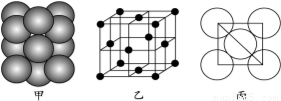
若已知该元素的原子半径为d cm,相对原子质量为M,NA代表阿伏加德罗常数,则该晶体的密度为 g·cm-3(用字母表示)。


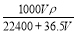 mol·L-1 B.
mol·L-1 B.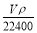 mol·L-1
mol·L-1 mol·L-1 D.
mol·L-1 D.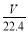 mol·L-1
mol·L-1 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法: