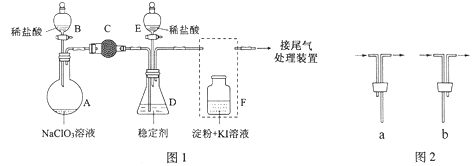
题目内容
【题目】下列说法不正确的是( )
A.为除去FeSO4溶液中的Fe2(SO4)3 , 可加入铁粉,再过滤
B.为除去溴苯中的溴,可用NaOH溶液洗涤,再分液
C.为除去乙炔气中少量的H2S,可使其通过CuSO4 溶液
D.为除去CO2 中少量的SO2 , 可使其通过饱和Na2CO3溶液
【答案】D
【解析】解:A.Fe与硫酸铁反应生成FeSO4 , 则加入铁粉,再过滤可除杂,故A正确;B.溴与NaOH溶液反应后,与溴苯分层,然后分液可除杂,故B正确;
C.硫化氢与硫酸铜反应,而乙炔不能,则可使其通过CuSO4 溶液、洗气除杂,故C正确;
D.二者均与碳酸钠溶液反应,不能除杂,应使其通过饱和NaHCO3溶液除杂,故D错误;
故选D.

练习册系列答案
相关题目