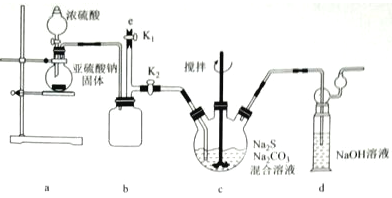
题目内容
【题目】第二次世界大战期间丹麦科学家玻尔被迫离开德军占领的祖国.为了表明一定要返回祖国的决心,他把心爱的金质诺贝尔奖章放在盛有“王水”(浓盐酸和浓硝酸的混合物)的玻璃容器中:Au+HNO3+3HCl═AuCl3+NO↑+2H2O.战后玻尔返回祖国,从溶液中提取出金,又重新铸造成奖章.下列方法中,不能从溶有金的王水中提取出金的是( )
A.萃取
B.蒸发灼烧
C.用Fe置换
D.电解
【答案】A
【解析】解:A.Au以化合态形式存在于溶液中,不能用萃取的方法分离,故A错误;
B.先蒸发水分后灼烧固体,可分解生成金,故B正确;
C.铁比金活泼,可置换出金,故C正确;
D.电解溶有黄金的王水,可在阴极上析出金,故D正确;
故选A.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目