题目内容
(1)填写下表
|
物质(杂质) |
除去杂质 所需试剂或方法 |
离子方程式 (若无离子方程式,则写化学方程式) |
|
Fe(Al) |
|
|
|
SiO2(CaCO3) |
|
|
|
CO2(HCl) |
|
|
|
NaHCO3溶液(Na2CO3) |
|
|
|
Na2CO3(NaHCO3) |
|
|
|
Al2O3(Al(OH)3) |
|
|
(2)将二氧化硫通入到氯化钡溶液中未见到明显现象,继续通入向该溶液中滴加氯水或氨水,均见到白色沉淀产生,该沉淀的成分分别为 或 ,请分别写出发生反应的离子方程式 , 。
(15分)(1)
|
物质(杂质) |
除去杂质所需试剂 |
离子方程式 |
|
Fe(Al) |
氢氧化钠溶液 |
2Al+ 2OH-+ 2H2O=AlO2-+ 3H2↑ |
|
SiO2(CaCO3) |
盐酸 |
CaCO3+ 2H+= Ca2+ + CO2↑+ H2O |
|
CO2(HCl) |
饱和碳酸氢钠溶液 |
HCO3-+ H+=H2O+ CO2↑ |
|
NaHCO3溶液(Na2CO3) |
CO2 |
CO32-+ CO2+ H2O=2HCO3- |
|
Na2CO3(NaHCO3) |
氢氧化钠溶液 或加热 |
HCO3-+ OH-=CO32-+ H2O 或2NaHCO3 |
|
Al2O3(Al(OH)3) |
加热 |
2Al(OH)3 |
(2)BaSO4 BaSO3 Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-
Ba2++2NH3+H2O+SO2=BaSO3↓+2NH4+
【解析】
试题分析:(1)铁、铝均是金属活动顺序表中氢前金属,都能溶于稀盐酸,铁不能溶于氢氧化钠溶液,而铝能溶于氢氧化钠溶液,生成偏铝酸钠和氢气,因此氢氧化钠溶液可以除去铁中混入的少量铝;二氧化硅不溶于水和盐酸,碳酸钙难溶于水,易溶于盐酸,生成氯化钙、二氧化碳和水,因此盐酸可以除去二氧化硅中混入的碳酸钙;二氧化碳不能与碳酸氢钠反应,其溶解度较小,难溶于饱和碳酸氢钠,氯化氢的溶解度较大,易溶于饱和碳酸氢钠,且与之反应生成氯化钠、二氧化碳和水,因此可用饱和碳酸氢钠溶液除去CO2中混入的HCl;CO2与Na2CO3溶液能反应生成NaHCO3,因此可以通入足量CO2气体除去碳酸氢钠溶液中混有的碳酸钠;碳酸氢钠可以转化为碳酸钠,加入适量的NaOH中和碳酸氢钠,或者加热,使不稳定的碳酸氢钠分解为碳酸钠、二氧化碳和水;氧化铝稳定,氢氧化铝受热易分解为氧化铝和水;(2)、二氧化硫具有还原性,也具有酸性氧化物的通性,氯水能氧化SO2,NH3能中和SO2;前者出现白色沉淀的原因是SO2+Cl2+2H2O=4H++2Cl-+SO42—,Ba2++SO42—=BaSO4↓,后者的原因是SO2+2NH3+2H2O=2NH4++SO32—、Ba2++SO32—=BaSO4↓。
考点:考查混合物的分离与提纯、离子方程式或化学方程式的书写、铝、氧化铝、氢氧化铝、碳酸钠、碳酸氢钠、二氧化硅、碳酸钙、HCl、二氧化硫、氯气、氨气、硫酸盐、亚硫酸盐的重要化学性质等相关知识。

(6分)元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。请依据元素周期表回答问题。
(1)填写下表
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 原子序数 | 6 |
|
| 13 |
| 元素周期表中的位置 |
| 第二周期 第VIA族 | 第三周期 第IA族 |
|
(2)丙的原子结构示意图是 ,该元素与同周期VIIA族元素组成的化合物类型是 。
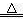 Na2CO3+CO2↑+ H2O
Na2CO3+CO2↑+ H2O (2006?乐山一模)有位同学只用了一个圆底烧瓶、带玻璃管的橡皮塞、胶皮管、酒精灯、少量浓氨水、大烧杯及水即做成了喷泉实验.他是怎样做这个实验的?应用了什么原理?回答下列问题:
(2006?乐山一模)有位同学只用了一个圆底烧瓶、带玻璃管的橡皮塞、胶皮管、酒精灯、少量浓氨水、大烧杯及水即做成了喷泉实验.他是怎样做这个实验的?应用了什么原理?回答下列问题: