题目内容
【题目】下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(4)小题用元素符号或化学式回答,(5)~(7)小题按题目要求回答。
族 周期 | I A | Ⅱ A | Ⅲ A | Ⅳ A | Ⅴ A | Ⅵ A | Ⅶ A | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是____,只有负价而无正价的是____,氧化性最强的单质是___,还原性最强的单质是_____。
(2)A分别与D、E、F、G、H形成的化合物中,最稳定的________。
(3)在B、C、E、F、G、H中,原子半径最大的是________。
(4)A和D组成化合物的电子式________。
(5)画出F的原子结构示意图_____。
(6)用电子式表示B和H组成化合物的形成过程:________。
(7)写出B的最高价氧化物的水化物和C的最高价氧化物的水化物反应的离子方程式:________。
【答案】Ne F F2 Na HF Na 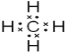
![]()
![]() OH-+ Al(OH)3= AlO2-+2H2O 或OH-+ Al(OH)3=Al(OH)4-
OH-+ Al(OH)3= AlO2-+2H2O 或OH-+ Al(OH)3=Al(OH)4-
【解析】
由元素在周期表中位置,可以知道A为H、B为Na、C为Al、D为C、E为N、F为P、G为F、H为Cl、I为Ne。
(1)根据分析可知稀有气体Ne原子最外层为稳定结构,化学性质最不活泼;F元素只有负价,没有正化合价;同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强,故上述元素中F元素非金属性增强,单质F2氧化性最强,Na元素金属性最强,单质还原性最强,因此,本题正确答案是:Ne;F;F2;Na。
(2)同周期自左向右非金属性增强,气态氢化物稳定性增强,同主族自上而下非金属性减弱,气态氢化物稳定性减弱,A分别与D、E、F、G、H形成的化合物中,HF最稳定,因此答案是:HF。
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径最大的是Na,因此,本题正确答案是:Na。
(4)A和D组成最简单化合物为CH4,分子中C原子与H原子之间形成共用电子对,其电子式为: 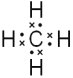 ,因此,本题正确答案是:
,因此,本题正确答案是:  。
。
(5) F为P, P的原子结构示意图![]() ;答案:
;答案:![]() 。
。
(6) B为Na ,H为Cl ,B和H组成化合物为NaCl,NaCl属于离子化合物,钠离子与氯离子间形成离子键,其形成过程的电子式表示为:![]() ,因此,本题正确答案是:
,因此,本题正确答案是: ![]() 。
。
(7)B的最高价氧化物的水化物为氢氧化钠,C的最高价氧化物的水化物为氢氧化铝,二者反应生成偏铝酸钠与水,反应的离子方程式为: OH-+ Al(OH)3= AlO2-+2H2O 或OH-+ Al(OH)3=Al(OH)4-,因此,本题正确答案是: OH-+ Al(OH)3= AlO2-+2H2O 或OH-+ Al(OH)3=Al(OH)4-。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案【题目】图中U→Z六种物质在适当条件下能实现图示箭头方向一步转化,且反应①、②均为置换反应,满足条件的物质组是( )
序号 | U | W | Y | X |
|
① | Na | H2O | Na2O2 | NaOH | |
② | Fe | H2O | C | H2 | |
③ | HBr | Cl2 | H2O | HC1 | |
④ | CuCl2 (aq) | A1 | HCl(aq) | AlCl3(aq) |
A. ②④ B. ②③ C. ①②④ D. ①②③④