题目内容
【题目】向300mL 2.0mol·L-1盐酸中加入几小块大理石,产生气体的体积随时间的变化曲线如右图所示(气体体积均在标准状况下测定)试回答下列问题:
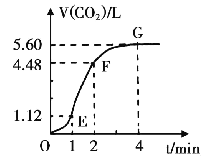
(1)若以反应中消耗的HCl表示反应速率,设OE段的反应速率为v1,EF段的反应速率为v2,FG段的反应速度为v3,则v1v2v3从大到小的顺序为 ,其中造成v1和v2大小关系的主要原因是
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是 (填编号)
A.蒸馏水 B.Na2CO3 C.氯化钠溶液 D.浓盐酸
(3)若反应过程中溶液体积的变化忽略不计,则EF段用盐酸表示的化学反应速率v(HCl)= ______mol·L-1·min-1
【答案】(1)v2>v1>v3; 因该反应是放热反应,EF段的温度高;(2)AC;(3)1.0。
【解析】
试题分析:(1)此反应属于放热反应,EF段的温度高于OE段,温度起主要作用,因此v2>v1,FG反应物浓度最小,浓度起主要作用,因此反应速率最小,即v2>v1>v3;(2)CaCO3+2H+=Ca2++CO2↑+H2O,A、加入蒸馏水,稀释盐酸,c(H+)降低,反应速率降低,故正确;B、加入Na2CO3,Na2CO3溶于水,增加和盐酸的接触面积,反应速率加快,故错误;C、氯化钠溶液,相当于稀释盐酸,c(H+)降低,反应速率减缓,故正确;D、加入浓盐酸,c(H+)增大,反应速率加快,故错误;(3)根据化学反应速率的定义,消耗的n(HCl)=2n(CO2)=(4.48-1.12)×2/22.4mol=0.3mol,v(HCl)=0.3/(300×10-3×1)mol/(L·min)=1.0 mol/(L·min)。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目