��Ŀ����
����Ŀ��þ���仯������������������Ӧ�ù㷺��
��.��1��þ��Ԫ�����ڱ��е�λ��Ϊ___________
��2��þ��̼���ﳣ������MgC2��Mg2C3���֣��ɷֱ���ˮ�ⷴӦ������Ȳ�ͱ���ϩ��д��MgC2ˮ�ⷴӦ�ķ���ʽΪ_________;Mg2C3�ĵ���ʽΪ_________.
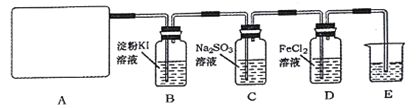
��3����Mg���Ƴ���þһ����������ȼ�ϵ�أ���װ��ʾ��ͼ����ͼ��ʾ���õ�ط�Ӧ�����ӷ���ʽΪ____________.
��.�����ȼҵ����[��Mg(OH)2��������CaCO3��MnCO3��FeCO3��Al(OH)3��SiO2��]����MgSO4��7H2O�Ĺ�����������ͼ��ʾ��
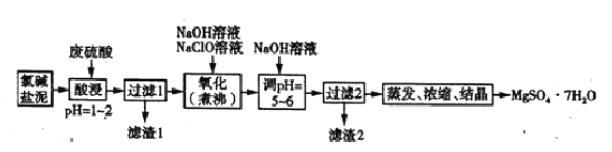
��4�����ʱ��FeCO3�����ᷴӦ�Ļ�ѧ����ʽΪ_____________��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ��_____(����ĸ)��
a.����÷������ȡ b.��С�������Ȳ���ֽ��� c.�ʵ��ӳ���ȡʱ��
��5������ʱ������������Һ��MnSO4����ΪMnO2�����ӳ�ʽΪ______________;����2ΪMnO2��_____________��___________(�ѧʽ)��
���𰸡� ����������A�� MgC2+2H2O=Mg(OH)2+C2H2�� ![]() Mg+ClO-+H2O=Cl-+Mg(OH)2 FeCO3+H2SO4=FeSO4+CO2��+H2O abc Mn2++2OH-+ClO-=MnO2��+Cl-+H2O Fe(OH)3 Al(OH)3
Mg+ClO-+H2O=Cl-+Mg(OH)2 FeCO3+H2SO4=FeSO4+CO2��+H2O abc Mn2++2OH-+ClO-=MnO2��+Cl-+H2O Fe(OH)3 Al(OH)3
���������������������ͨ��þ���仯������о�����Ҫ����Ԫ��ԭ�ӽṹ���������ڱ���λ�õĹ�ϵ��ˮ��ԭ��������ʽ��ԭ��ط�Ӧԭ����������ѧ��Ӧ����ʽ����ѧ��Ӧ���ʵ�Ӱ�����صȻ���֪ʶ�����鿼��ԭ���װ�õķ�����������ҵ���̵ķ��������ͶԻ���֪ʶ���ۺ�����������
��������1��MgΪ12��Ԫ�أ���ԭ�ӽṹΪ![]() ������Mg�����ڱ��е������ڢ�A����ȷ�𰸣��������ڢ�A����2��MgC2����ˮ�ⷴӦ������Ȳ��������Ȳ�е�Hԭ����Դ��H2O�������ɵ�H+����OH-��Mg2+�������Mg(OH)2�����Է�Ӧԭ����MgC2+2H2O=Mg(OH)2+C2H2����ͬ����Mg2C3����ˮ�ⷴӦ���ɱ���ϩ���������ϩ��
������Mg�����ڱ��е������ڢ�A����ȷ�𰸣��������ڢ�A����2��MgC2����ˮ�ⷴӦ������Ȳ��������Ȳ�е�Hԭ����Դ��H2O�������ɵ�H+����OH-��Mg2+�������Mg(OH)2�����Է�Ӧԭ����MgC2+2H2O=Mg(OH)2+C2H2����ͬ����Mg2C3����ˮ�ⷴӦ���ɱ���ϩ���������ϩ��![]() ����Hԭ����Դ��H2O�������ɵ�H+������Mg2C3�к���
����Hԭ����Դ��H2O�������ɵ�H+������Mg2C3�к���![]() ����Mg2C3����ʽΪ
����Mg2C3����ʽΪ![]() ����ȷ�𰸣�MgC2+2H2O=Mg(OH)2+C2H2����
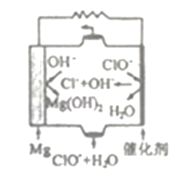
����ȷ�𰸣�MgC2+2H2O=Mg(OH)2+C2H2���� ![]() ����3����ԭ������Mg��Ӧ����Mg(OH)2���õ缫Ϊ�������Ҳ�ClO-��Ӧ����Cl-��OH-���õ缫Ϊ�������ܷ�ӦΪMg+ClO-��Mg(OH)2+Cl-����ƽ��Mg+ClO-+H2O=Cl-+Mg(OH)2����ȷ�𰸣�Mg+ClO-+H2O=Cl-+Mg(OH)2����4�����ʱ��FeCO3��H2SO4��Ӧԭ��ΪFeCO3+H2SO4=FeSO4+CO2��+H2O��������߽�ȡ�ʣ�a����ν�ȡ����ʹʣ���Mg(OH)2����ֲ��뷴Ӧ��������߽�ȡ�ʣ�b����С�������Ȳ���ֽ������ʹ��Ӧ����֣�������Mg2+������c���ʵ��ӳ���ȡʱ�����ʹMg(OH)2��Ӧ����֣�����abc����ȷ����ȷ�𰸣�FeCO3+H2SO4=FeSO4+CO2��+H2O��abc����5������֪�÷�Ӧ��������ΪClO-+Mn2+��MnO2��Mn2+����������MnO2����ClO-����ԭ����Cl-�����ǵ���Ӧ�����м�����NaOH����ƽ���Mn2++2OH-+ClO-=MnO2��+Cl-+H2O�������������ܹ��ܽ�Mg(OH)2��CaCO3��MnCO3��FeCO3��Al(OH)3 ����������1��SiO2������������Mn2+����MnO2������Fe2+��������Fe3+�����Լ���NaOH����pH 5~6ʱ��Fe3+ת���Fe(OH)3������Al3+ת���Al(OH)3������ ��������2����MnO2��Fe(OH)3��Al(OH)3����ȷ�𰸣�Mn2++2OH-+ClO-=MnO2��+Cl-+H2O����Fe(OH)3��Al(OH)3��
����3����ԭ������Mg��Ӧ����Mg(OH)2���õ缫Ϊ�������Ҳ�ClO-��Ӧ����Cl-��OH-���õ缫Ϊ�������ܷ�ӦΪMg+ClO-��Mg(OH)2+Cl-����ƽ��Mg+ClO-+H2O=Cl-+Mg(OH)2����ȷ�𰸣�Mg+ClO-+H2O=Cl-+Mg(OH)2����4�����ʱ��FeCO3��H2SO4��Ӧԭ��ΪFeCO3+H2SO4=FeSO4+CO2��+H2O��������߽�ȡ�ʣ�a����ν�ȡ����ʹʣ���Mg(OH)2����ֲ��뷴Ӧ��������߽�ȡ�ʣ�b����С�������Ȳ���ֽ������ʹ��Ӧ����֣�������Mg2+������c���ʵ��ӳ���ȡʱ�����ʹMg(OH)2��Ӧ����֣�����abc����ȷ����ȷ�𰸣�FeCO3+H2SO4=FeSO4+CO2��+H2O��abc����5������֪�÷�Ӧ��������ΪClO-+Mn2+��MnO2��Mn2+����������MnO2����ClO-����ԭ����Cl-�����ǵ���Ӧ�����м�����NaOH����ƽ���Mn2++2OH-+ClO-=MnO2��+Cl-+H2O�������������ܹ��ܽ�Mg(OH)2��CaCO3��MnCO3��FeCO3��Al(OH)3 ����������1��SiO2������������Mn2+����MnO2������Fe2+��������Fe3+�����Լ���NaOH����pH 5~6ʱ��Fe3+ת���Fe(OH)3������Al3+ת���Al(OH)3������ ��������2����MnO2��Fe(OH)3��Al(OH)3����ȷ�𰸣�Mn2++2OH-+ClO-=MnO2��+Cl-+H2O����Fe(OH)3��Al(OH)3��

����Ŀ������β�����ŷŵ�NOx��CO��Ⱦ������������β��ϵͳ��װ�ô�ת����������Ч����NOx��CO���ŷš�
��֪:��2CO(g)+O2(g)![]() 2CO2(g) ��H=-akJ/mol
2CO2(g) ��H=-akJ/mol
��N2(g)+O2(g)![]() 2NO(g) ��H=+bkJ/mol
2NO(g) ��H=+bkJ/mol
��2NO(g)+O2(g)![]() 2NO2(g) ��H=-ckJ/mol
2NO2(g) ��H=-ckJ/mol
�ش���������:
��1��CO��ȼ����Ϊ_________��
��2��CO��NO2��ԭΪ���ʵ��Ȼ�ѧ����ʽΪ_________��
��3��Ϊ��ģ�ⷴӦ2NO(g)+2CO(g)![]() N2(g)+2CO2(g)�ڴ�ת�����ڵĹ������������һ���������÷�Ӧ�ں����ܱ������н��У��ô�������ò�ͬʱ��NO��CO��Ũ�����±�:
N2(g)+2CO2(g)�ڴ�ת�����ڵĹ������������һ���������÷�Ӧ�ں����ܱ������н��У��ô�������ò�ͬʱ��NO��CO��Ũ�����±�:
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
��ǰ2s�ڵ�ƽ����Ӧ����v(N2)=_________,���¶��£��÷�Ӧ��ƽ�ⳣ��K=_________��
����˵��������Ӧ�ﵽƽ��״̬����________��
A.2n(CO2)=n(N2) B.��������ƽ����Է�����������
C.�����ܶȲ��� D.����������ѹǿ����
�۵�NO��COŨ�����ʱ����ϵ��NO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
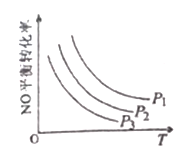
��NO��ƽ��ת�������¶����߶���С��ԭ����______________��ͼ��ѹǿ(P1��P