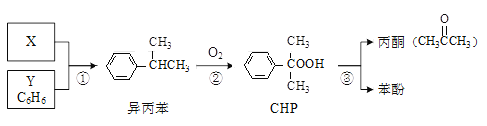
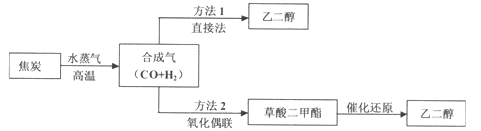
题目内容
【题目】有一种水果香精乙酸正丁酯的合成提纯步骤如下:
(1)合成:在干燥的圆底烧瓶中加11.5mL(9.3g,0.125mol)正丁醇 、3~4滴浓H2SO4、7.2mL(7.5g,0.125mol)冰醋酸,摇匀后,加几粒沸石,再按图1所示装置安装好。在分水器(分离出生成的水)中预先加入5.00mL水,其水面低于分水器回流支管下沿3~5mm,然后用小火加热,反应大约40min。
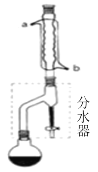
(2)分离提纯:
① 当分水器中的液面不再升高时,冷却,从分水器下端放出分水器中的水,把反应后的烧瓶中的溶液与分水器中的酯层合并,转入分液漏斗中,用10mL10%碳酸钠溶液洗至酯层无酸性(pH=7),充分震荡后静置,分去水层。
② 将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥(生成MgSO47H2O晶体)。
③ 将乙酸正丁酯粗产品转入50mL图中的仪器中,加几粒沸石进行加热,收集产品,主要试剂及产物的物理常数如下:

化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
制备过程中还可能存在的副反应有:2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O。根据以上信息回答下列问题:
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O。根据以上信息回答下列问题:
(1)写出合成乙酸正丁酯的化学方程式_________。
(2)步骤①中碳酸钠溶液的作用主要是___________,若改用NaOH溶液洗涤酯层,收集到的产物比预期少,原因是:_____________。
(3)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先___________(填实验操作名称),步骤③中加热分离有机物的实验方法名称是______________。
(4)步骤③的常压蒸馏,需控制一定的温度,你认为在______中加热比较合适(请从下列选项中选择)。
A.水 B.甘油(沸点290℃) C.沙子 D.石蜡油(沸点200~300℃)
(5)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的转化率约为:______________。
【答案】CH3CH2CH2CH2OH+CH3COOH![]() CH3COOCH2CH2CH2CH3+H2O 除去硫酸、乙酸、正丁醇,降低酯的溶解度 产物会在氢氧化钠溶液中水解了部分 过滤 蒸馏 B、D 88%
CH3COOCH2CH2CH2CH3+H2O 除去硫酸、乙酸、正丁醇,降低酯的溶解度 产物会在氢氧化钠溶液中水解了部分 过滤 蒸馏 B、D 88%
【解析】
(1)正丁醇与冰醋酸在浓H2SO4加热条件下发生酯化反应生成乙酸正丁酯和水;
(2)乙酸正丁酯中含有乙酸、正丁醇、正丁醚和硫酸杂质,其中正丁醇、硫酸易溶于水,而乙酸正丁酯、正丁醚难溶于水,乙酸可与饱和碳酸钠反应,以此解答该题;
(3)酯层用无水硫酸镁干燥后,应过滤除去干燥剂;
(4)乙酸正丁酯的沸点是126.1℃,选择沸点稍高的液体加热;
(5)计算生成水的质量,根据方程式计算参加反应正丁醇的产量,正丁醇的利用率等于参加反应的质量与投入的总质量。
(1)正丁醇与冰醋酸在浓H2SO4加热条件下发生酯化反应生成乙酸正丁酯和水,化学方程式为CH3CH2CH2CH2OH+CH3COOH![]() CH3COOCH2CH2CH2CH3+H2O;
CH3COOCH2CH2CH2CH3+H2O;
(2)根据反应的原理和可能的副反应,乙酸正丁酯中含有乙酸、正丁醇、正丁醚和硫酸杂质,乙酸正丁酯、正丁醚不溶于饱和碳酸钠溶液,而正丁醇、硫酸易溶,乙酸可与碳酸钠反应而被吸收,可用饱和碳酸钠溶液除去乙酸正丁酯中乙酸、正丁醇和硫酸杂质;若改用NaOH溶液洗涤酯层,反应生成的酯会与NaOH发生反应,收集到的产物比预期少;
(3)酯层用无水硫酸镁干燥后,应过滤除去干燥剂;步骤③中加热分离有机物的实验方法名称是蒸馏;
(4)乙酸正丁酯的沸点是126.1℃,选择沸点稍高的液体加热,所以可以在甘油和石蜡油中选择加热的物质,水的沸点为100℃,低于乙酸正丁酯的沸点,用砂子加热温度太高不易控制且浪费能源,故选BD;
(5)反应结束后,若放出的水为6.98mL(水的密度为1g·mL-1),则反应生成的水为6.98mL-5.00mL=1.98mL,即1.98g,设参加反应的正丁醇为x,

解得x=![]() =8.14g,则则正丁醇的转化率=
=8.14g,则则正丁醇的转化率=![]() =
=![]() =88%。
=88%。

【题目】根据下列实验事实得出的相应结论正确的是( )
选项 | 实验事实 | 结论 |
A | NH3 的水溶液可以导电 | NH3 是电解质 |
B | SO2 通入硝酸钡溶液出现白色沉淀 | BaSO3 不溶于强酸 |
C | 浓硝酸久置发黄 | 硝酸不稳定 |
D | 浓硫酸能脱去胆矾晶体中的水 | 浓硫酸具有脱水性 |
A.AB.BC.CD.D