题目内容
某课题组进行实验研究时,欲配制浓度均为1.0mol?L-1的Ba(OH)2和H2SO4溶液.Ⅰ.该组同学在配制Ba(OH)2溶液时,只找到在空气中暴露已久的Ba(OH)2?8H2O试剂(相对分子质量:315),发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物.
(1)用化学方程式解释未溶物产生的原因
(2)某同学查得Ba(OH)2?8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6.据此认为即便使用纯净的Ba(OH)2?8H2O,在室温下也不能配得1.0mol?L-1Ba(OH)2溶液,其理由是:
Ⅱ.用18mol?L-1的浓硫酸配制450mL 1.0mol?L-1稀硫酸.
(3)实验时,需量取浓硫酸的体积为
(4)配制溶液时,定容的操作方法是:
(5)实验中下列情况会使所配溶液浓度偏高的是
A.洗涤量取浓硫酸的量筒2~3次,并将洗涤液转入容量瓶中
B.定容时仰视刻度线
C.振荡摇匀后再重新加水至刻度线
D.用水洗涤容量瓶未干燥.
(2)粗略计算出室温下氢氧化钡饱和溶液的物质的量浓度,再进行判断能够配制1.0mol?L-1Ba(OH)2溶液;
(3)根据溶液稀释过程中溶质的物质的量不变计算出需要浓硫酸的体积;根据配制一定浓度的溶液步骤选用仪器,然后判断还缺少的仪器名称;
(4)根据配制一定物质的量浓度的溶液过程中正确的定容方法进行解答;
(5)根据c=
| n |
| V |
故答案为:Ba(OH)2+CO2═BaCO3+H2O;
(2)室温下氢氧化钡晶体的溶解度为3.9g,100g氢氧化钡晶体的溶液体积约为100mL,3.9g氢氧化钡晶体的物质的量为:
| 3.9g |
| 315g/mol |
| 0.012mol |
| 0.1L |
故答案为:室温下,Ba(OH)2饱和溶液的浓度只约为0.12 mol?L-1;
(3)用18mol?L-1的浓硫酸配制450mL 1.0mol?L-1稀硫酸,实验室没有450mL的容量瓶,需要选用500mL容量瓶配制500mL的溶液,需要浓硫酸的体积为:
| 1.0mol/L×0.5L |
| 18mol/L |
故答案为:27.8;胶头滴管;500 mL容量瓶;
(4)配制500mL 1.0mol/L的稀硫酸过程中,定容的正确操作方法为:直接加水离刻度线1~2 cm,然后改用胶头滴管逐滴滴加至刻度线,
故答案为:加水离刻度线1~2 cm,改用胶头滴管逐滴滴加至刻度线;
(5)A.洗涤量取浓硫酸的量筒2~3次,并将洗涤液转入容量瓶中;量筒不能洗涤,否则会导致量取的浓硫酸的体积偏大,配制的溶液浓度偏高,故A正确;
B.定容时仰视刻度线,导致加入的蒸馏水体积偏大,配制的溶液体积偏大,溶液的浓度偏低,故B错误;
C.振荡摇匀后再重新加水至刻度线,导致加入的蒸馏水体积偏大,配制的溶液浓度偏低,故C错误;
D.用水洗涤容量瓶未干燥,容量瓶中少量的蒸馏水对溶质的物质的量及溶液的最终体积都没有影响,不影响配制结果,故错误;
故答案为:A.

草酸亚铁晶体(FeC2O4·2H2O)呈淡黄色。某课题组为探究草酸业铁晶体的化学性质, 进行了一系列实验探究。
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成。这说明草酸亚铁晶体具有 (填“氧化性”、“还原性”或“碱性”)。若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为 mol。
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体。课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO
假设二:
假设三:
(3)为验证上述假设一是否成立,课题组进行如下研究。
【定性研究】请你完成下表中内容。
|
实验步骤(不要求写出具体操作过程) |
预期实验现象和结论 |
|
取少量黑色固体,
|
|
【定量研究】课题组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,FeC2O4·2H2O晶体受热分解的化学方程式为: 。

根据图象,如有1.0 g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4 g。某同学由此得出结论:假设一不成立。你是否同意该同学的结论,并简述理由:
 (2012?安徽)工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.
(2012?安徽)工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.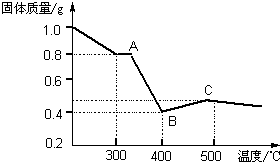 [定量研究]课题组在文献中查阅到,FeC2O4?2H2O受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时,FeC2O4?2H2O晶体受热分解的化学方程式为:
[定量研究]课题组在文献中查阅到,FeC2O4?2H2O受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时,FeC2O4?2H2O晶体受热分解的化学方程式为: