题目内容
用惰性电极电解足量的下列溶液,一段时间后,加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是
A.CuCl2[CuSO4] B.NaOH[H2O] C.NaCl[H2O] D.CuSO4[Cu(OH)2]
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占锯3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子。
(1)基态E原子的核外电子排布式为______;基态D原子核外电子占据的能量最高的能级符号为_____________。
(2)A元素的各级电离能如下:
能级(I) | I1 | I2 | I3 | I4 | I5 |
电离能/kJ·mol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
分析上表数据知,相邻两个电子的电离能中,I3和I4之间差异最大,其主要原因是______________。
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是________。
(4)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp3杂化、立体构型为三角锥形的是_______(填分子式)。
(5)(DC)4为热色性固体,且有色温效应。低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色。在淡黄色→橙黄色→深红色的转化中,破坏的作用力是____;在常压下,(DC)4高于130℃分解为相应的单质,这一变化中破坏的作用力是_______。在B、C、D的简单气态氢化物中,属于非极性分子的是______(填分子式,下同),常与Cu2+、Zn2+、Ag+等形成配离子的是_______________。
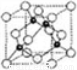
(6)A、C形成立方晶体,晶体结构类似金刚石,如图所示。已知:该晶体密度为ρg·㎝-3,NA代表阿伏伽德罗常数的值。
①该晶体的化学式为__________。
②在该晶体中,A与C形成共价键的键长(d)为_____pm。
某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。

实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜(不稳定) | 氯化亚铜 |
颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
※ 相同温度下CuCl的溶解度大于CuOH。
下列说法错误的是( )
A. 反应结束后最终溶液呈碱性 B. 阴极上发生的电极反应为:2H2O + 2e- == H2↑+ 2OH-
C. 电解过程中氯离子移向阳极 D. 试管底部红色的固体具有还原性



