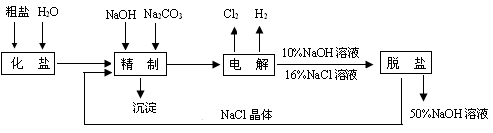
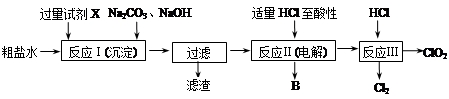
题目内容
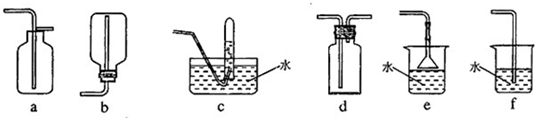
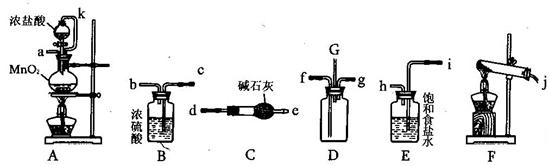
(6分)请从下图中选出必要的装置进行电解饱和食盐水的实验,要求测定产生的H2的体积(大于25 mL),并检验Cl2的氧化性。
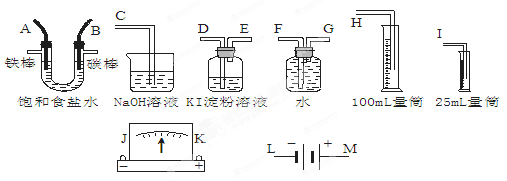
(1)A极发生的电极反应式是______________,B极发生的电极反应式是_____________。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:______接______、______接A、B接______、______接______。(填气体接口字母)

(1)A极发生的电极反应式是______________,B极发生的电极反应式是_____________。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:______接______、______接A、B接______、______接______。(填气体接口字母)
(1)阴极:2H++2e-=H2↑;阳极:2Cl-—2e-=Cl2↑(2)H F G D E C
试题分析:(1)若电解饱和NaCl溶液来测定产生的H2的体积并检验Cl2的氧化性。则应该使A与电源的负极连接,作阴极,在该电极上发生反应:2H++2e-=H2↑;B与电源的正极连接,作阳极,该电极发生的电极反应是:2Cl-—2e-=Cl2↑;(2)设计上述气体实验装置时,由于产生的H2的体积大于25 mL,所以应该选择100ml的量筒,各接口的正确连接顺序为H接F、G接A、B接D、E接C。

练习册系列答案
相关题目