题目内容
【题目】矿物透闪石是制作玉器的一种原料,其化学式可用CaxMgySi8O22(OH)m表示。为确定其组成,进行如下实验:
①准确称取16.20g样品粉末,加入足量稀盐酸充分溶解,过滤,将沉淀灼烧得固体9.60g。
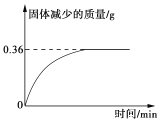
②另准确称取16.20克样品粉末在空气中灼烧,样品减少的质量随灼烧时间的变化如图所示。下列说法正确的是
A. 化学式中x、y、m的代数关系式为2x+2y=m
B. CaxMgySi8O22(OH)m改写成氧化物的形式为xCaO·yMgO·8SiO2·mH2O
C. 对矿物样品粉末灼烧至恒重,则减少的质量与灼烧后固体中Si元素的质量比约为0.04m
D. 根据实验结果,可确定样品的化学式为Ca2Mg8Si8O22(OH)4
【答案】C
【解析】A、CaxMgySi8O22(OH)m改写成氧化物的形式为xCaOyMgO8SiO2![]() H2O,根据电荷守恒有:2x+2y+4×8=22×2+m,整理得2x+2y+12= m ,选项A错误;B、CaxMgySi8O22(OH)m改写成氧化物的形式为xCaOyMgO8SiO2
H2O,根据电荷守恒有:2x+2y+4×8=22×2+m,整理得2x+2y+12= m ,选项A错误;B、CaxMgySi8O22(OH)m改写成氧化物的形式为xCaOyMgO8SiO2![]() H2O,选项B错误;C、固体加热得到CaO、MgO、SiO2、H2O,固体减少质量为水的质量,根据原子守恒,则减少的质量与灼烧后固体中Si元素的质量比为
H2O,选项B错误;C、固体加热得到CaO、MgO、SiO2、H2O,固体减少质量为水的质量,根据原子守恒,则减少的质量与灼烧后固体中Si元素的质量比为![]() =
=![]() 0.04m,选项C正确;D、n(SiO2)=
0.04m,选项C正确;D、n(SiO2)=![]() =0.08 mol,CaxMgySi8O22(OH)m的摩尔质量M=
=0.08 mol,CaxMgySi8O22(OH)m的摩尔质量M=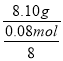 =810 g/mol, n(H2O)=
=810 g/mol, n(H2O)=![]() =0.02 mol,16.2gCaxMgySi8O22(OH)m的物质的量为
=0.02 mol,16.2gCaxMgySi8O22(OH)m的物质的量为![]() =0.02mol, m=
=0.02mol, m=![]() =2,根据电荷守恒:2x+2y+4×8=22×2+2,整理得:x+y=7…①;40 x+24 y+28×8+16×22+17×2=810…②;由①、②式得:x=2 、y=5 ,故化学式为:Ca2Mg5Si8O22(OH)2,选项D错误。答案选C。
=2,根据电荷守恒:2x+2y+4×8=22×2+2,整理得:x+y=7…①;40 x+24 y+28×8+16×22+17×2=810…②;由①、②式得:x=2 、y=5 ,故化学式为:Ca2Mg5Si8O22(OH)2,选项D错误。答案选C。