题目内容
18.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移4 NA个电子 | |
| B. | 16g甲基正离子(13CH3+)所含中子数为7NA | |
| C. | 10.0 mL 18mol/L的浓硫酸中氢离子数为0.36 NA | |
| D. | 标准状况下,1mol SO3含有的分子数为NA |
分析 A.反应中只有氧元素的化合价升高由-1升高到0价,依据方程式生成1mol氧气,转移2mol电子;
B.质量换算物质的量,结合质量数=质子数+中子数 计算离子中中子数;
C.浓硫酸里,大部分的是以分子形式存在;
D.气体摩尔体积使用对象为气体.
解答 解:A.32g氧气的物质的量为1mol,在H2O2+Cl2=2HCl+O2反应中,生成1mol氧气,转移2mol电子,转移2 NA个电子,故A错误;
B.16g甲基正离子(13CH3+)物质的量为1mol,含中子数为1mol×(13-6)=7mol,含中子数为7NA,故B正确;
C.浓硫酸里只含有很少的水,硫酸大部分的是以分子形式存在,只有少部分电离,所以,10.0 mL18.0mol/L的浓硫酸中氢离子数远小于0.36 NA,故C错误;
D.标况下三氧化硫不是气体,不能使用气体摩尔体积,故D错误;
故选:B.
点评 本题考查阿伏伽德罗常数的计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象,注意浓硫酸很难电离,题目难度不大.

练习册系列答案
相关题目
8.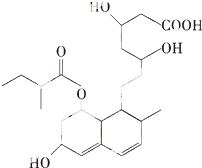 普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述不正确的是( )
普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述不正确的是( )
 普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述不正确的是( )
普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述不正确的是( )| A. | 3个-OH皆可发生催化氧化反应 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 能发生加成、取代、消去反应 | |
| D. | 1 mol该物质最多可与1mol NaOH反应 |
6.有机物B、C、D互为( )
| A. | 同位素 | B. | 同系物 | C. | 同分异构体 | D. | 同素异形体 |
3.一定条件下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),的化学平衡常数K=1,相同条件下,当C(CO2)=0.5mol•L-1、C(H2)=0.5mol•L-1、C(CO)=1mol•L-1、C(H2O)=1mol•L-1时,下列说法正确的是( )
| A. | 处于平衡状态,正逆反应速率相等 | |
| B. | 平衡逆移,正反应速率小于逆反应速率 | |
| C. | CO2的转化率为50% | |
| D. | 该条件下,学平衡常数K=4 |
10.下列关于物质的量的叙述,正确的是( )
| A. | 1mol任何物质均含有约6.02×1023个分子 | |
| B. | 0.012kg碳-12中含有约6.02×1023个碳原子 | |
| C. | 1mol水中含有2 mol氢和1mol氧 | |
| D. | 1mol H2含有6.02×1023个电子 |
7.同温同压下,某容器充满N2重114g,若充满He重102g,现充满某气体重116g,则某气体的相对分子质量为( )
| A. | 101 | B. | 17 | C. | 32 | D. | 10 |
 .
.