题目内容
2.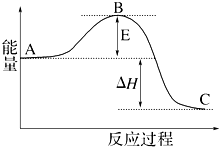 (1)2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1molSO2(g)氧化为1molSO3的△H=-99kJ•mol-1.请回答下列问题:
(1)2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1molSO2(g)氧化为1molSO3的△H=-99kJ•mol-1.请回答下列问题:图中E表示活化能,E的大小对该反应的反应热无(填“有”或“无”)影响;该反应通常用V2O5作催化剂,加V2O5会使图中B点降低 (填“升高”或“降低”); 图中△H=-198kJ•mol-1;
(2)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1
(3)已知在一定条件下,CO的燃烧热为-283kJ•mol-1,CH4的燃烧热为-890kJ•mol-1,由1mol CO和3mol CH4组成混合气体在上述条件下充分燃烧,释放的热量为2953kJ
(4)已知25℃、101kPa时下列反应的热化学方程式为:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l);△H1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g);△H2=-393.5kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H3=-285.8kJ/mol
试计算反应:
④2C(s)+2H2(g)+O2(g)═CH3COOH(l)在该条件下的反应热△H4=-488.3kJ/mol.
分析 (1)B为活化能,活化能的大小与反应热无关;催化剂改变反应速率通过参与反应过程,降低活化能实现;根据参加反应SO2的物质的量之比等于对应的△H之比进行解答;
(2)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,32g甲醇燃烧生成CO2和液态水时放热22.68kJ×32=725.76kJ,1mol甲醇质量为32克,所以完全燃烧1mol甲醇生成二氧化碳和液态水放热725.76KJ,根据燃烧热的概念分析即可解答;
(3)根据燃烧热是1mol可燃物质完全燃烧生成稳定氧化物放出的热量以及热化学反应方程式中物质的物质的量与反应放出的热量成正比来解答;
(4)利用盖斯定律吗,将②×2+③×2-①可得2C(s)+2H2(g)+O2(g)═CH3COOH(l),以此计算反应热,可得热化学方程式.
解答 解:(1)B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,加入催化剂能降低反应的活化能,加快化学反应速率,因1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ•mol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ•mol-1,
故答案为:无;降低;-198;
(2)1mol甲醇完全燃烧生成二氧化碳和液态水放热725.8KJ,燃烧热热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1;
(3)1molCO完全燃烧时释放的热量为283KJ,1molCH4完全燃烧时释放的热量为890KJ,所以1molCO和3molCH4燃烧后放出的热量为283KJ+890KJ×3=2953KJ,
故答案为:2953kJ;
(4)利用盖斯定律吗,将②×2+③×2-①可得2C(s)+2H2(g)+O2(g)═CH3COOH(l),
则△H4=2×(-393.5kJ/mol)+2×(-285.8kJ/mol)-(-870.3kJ/mol)=-488.3kJ/mol,
即2C(s)+2H2(g)+O2(g)═CH3COOH(l)在该条件下的反应热△H4=-488.3kJ/mol,
故答案为:-488.3kJ/mol.
点评 本题考查反应过程的能量变化图以及运用盖斯定律进行反应热的计算,难度不大,注意活化能与反应热的关系.

| A. | 与足量溴水反应 | B. | 通入酸性高锰酸钾溶液中 | ||
| C. | 在一定条件下通入氢气 | D. | 将其分别点燃 |
| A. | 铁粉加入三氯化铁溶液中:Fe+2Fe3+═3Fe2+ | |
| B. | 钠与水的反应Na+2H2O═Na++2OH -+H2↑ | |
| C. | 铜片插入硝酸银溶液中Cu+Ag+═Cu2++Ag | |
| D. | 大理石溶于醋酸的反应CaCO3+2H+═Ca2++CO2↑+H2O |

| A. | 两条曲线间任意点均有c(H+)×c(OH-)=KW | |
| B. | XZ线上任意点均有pH=7 | |
| C. | 图中T1<T2 | |
| D. | M区域内任意点均有c(H+)<c(OH-) |
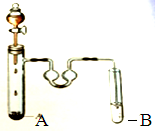 如图是制取溴苯的装置,试回答:
如图是制取溴苯的装置,试回答: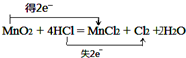 :
: