题目内容
【题目】在恒温恒容密闭容器中发生反应NH2COONH4(s)2NH3(g)+CO2(g),不能判断该反应已达到化学平衡的是( )
A. v正(NH3)=2v逆(CO2) B. 密闭容器中混合气体的平均摩尔质量不变
C. 密闭容器中混合气体的密度不变 D. 密闭容器中总压强不变
【答案】B
【解析】
A、v正(NH3)=2v逆(CO2)体现正逆反应速率相等的关系,能判断该分解反应已经达到化学平衡,选项A不选;B、反应体系中氨气和二氧化碳的物质的量之比是定值,所以混合气体的平均分子质量始终不变,不能判断该反应已达到化学平衡,选项B选;C、密闭容器中混合气体的密度ρ=![]() ,V不变,但是m变化,当密度不变,达到了平衡,此条件能判断该分解反应已经达到化学平衡,选项C不选;D、随着反应的进行体系压强逐渐增大,容器内压强保持不变说明达平衡状态,选项D不选。答案选B。
,V不变,但是m变化,当密度不变,达到了平衡,此条件能判断该分解反应已经达到化学平衡,选项C不选;D、随着反应的进行体系压强逐渐增大,容器内压强保持不变说明达平衡状态,选项D不选。答案选B。

【题目】科学家正在研究温室气体CH4和CO2的转化和利用。请回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用____________形象化描述。在基态14C原子中,核外存在___________对自旋相反的电子。
(2)CH4和CO2所含的三种元素电负性从小到大的顺序为__________________________。
(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/kJ·mol-1 |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
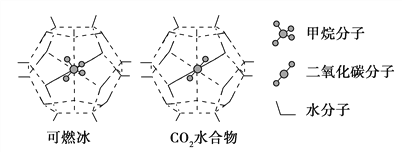
①下列关于CH4和CO2的说法正确的是________(填序号)。
a.CO2分子中含有2个σ键和2个π键
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0. 586 nm,根据上述图表所提供的数据分析,提出该设想的依据是______________________________________。