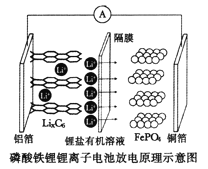
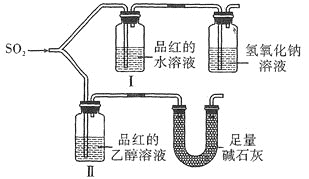
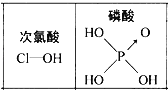
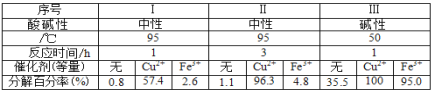
题目内容
【题目】下列有关说法正确的是
A.CaCO3(s) =CaO(s)+CO2(g) 在室温下不能自发进行,说明该反应![]() H<0
H<0
B.水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应
C.0.1mol·L-1Na2CO3溶液在50℃时的碱性比25℃强,说明盐类水解反应是放热反应
D.蒸发FeCl3溶液,所得固体在坩埚中充分加热,最后得到Fe2O3固体
【答案】D
【解析】
A. CaCO3(s) =CaO(s)+CO2(g),![]() ,在室温下不能自发进行,说明该反应
,在室温下不能自发进行,说明该反应![]() H>0,故A错误;
H>0,故A错误;
B. 水的离子积常数Kw 随着温度的升高而增大,说明加热时水的电离平衡正向移动,说明水的电离是吸热过程,故B错误;
C.碳酸钠水解显碱性,加热时碱性增强,说明水解程度增大,水解平衡正向移动,则正向为吸热方向,即水解为吸热反应,故C错误;
D.氯化铁在溶液中发生水解反应,![]() ,加热蒸干时氯化氢挥发,导致水解程度增大,最终产生氢氧化铁固体,氢氧化铁受热分解得到氧化铁固体,故D正确;
,加热蒸干时氯化氢挥发,导致水解程度增大,最终产生氢氧化铁固体,氢氧化铁受热分解得到氧化铁固体,故D正确;
故选:D。

练习册系列答案
相关题目