题目内容
(1)按要求完成下列反应的离子方程式:
(A)将一小片铜片加入稀硫酸中没有反应,再加入适量KNO3晶体,则铜片逐渐溶解,并产生无色气体:
(B)向氢氧化钡溶液中滴加明矾溶液至Ba2+完全沉淀:
(2)从下列各组反应中,判断哪种粒子的氧化性最强,哪种粒子的还原性最强.
(A)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质,则Cu、Fe、Ag中,
(B)铁钉在氯气中被锈蚀成棕褐色物质(FeCl3),而在盐酸中生成淡绿色溶液(FeCl2),则氯气分子、氢离子中
(A)将一小片铜片加入稀硫酸中没有反应,再加入适量KNO3晶体,则铜片逐渐溶解,并产生无色气体:
3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O
3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O
.(B)向氢氧化钡溶液中滴加明矾溶液至Ba2+完全沉淀:
2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O
2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O
,继续加入明矾溶液,又发生的反应为:Al3++3AlO2-+6H2O═4Al(OH)3↓
Al3++3AlO2-+6H2O═4Al(OH)3↓
.(2)从下列各组反应中,判断哪种粒子的氧化性最强,哪种粒子的还原性最强.
(A)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质,则Cu、Fe、Ag中,
Fe
Fe
原子还原性最强.(B)铁钉在氯气中被锈蚀成棕褐色物质(FeCl3),而在盐酸中生成淡绿色溶液(FeCl2),则氯气分子、氢离子中
Cl2
Cl2
氧化性最强(填化学式).分析:(1)(A)硝酸盐在酸性条件下具有强氧化性,与Cu发生氧化还原反应;
(B)氢氧化钡溶液中滴加明矾溶液至Ba2+完全沉淀,二者的物质的量之比为2:1;继续加入明矾溶液,发生相互促进水解的反应;
(2)(A)铁置换出Cu,Cu置换出Ag,氧化还原反应中还原剂的还原性大于还原产物的还原性;
(B)根据同种还原剂(变价金属)与不同氧化剂反应,金属的价态来分析.
(B)氢氧化钡溶液中滴加明矾溶液至Ba2+完全沉淀,二者的物质的量之比为2:1;继续加入明矾溶液,发生相互促进水解的反应;
(2)(A)铁置换出Cu,Cu置换出Ag,氧化还原反应中还原剂的还原性大于还原产物的还原性;
(B)根据同种还原剂(变价金属)与不同氧化剂反应,金属的价态来分析.
解答:解:(1)(A)硝酸盐在酸性条件下具有强氧化性,与Cu发生氧化还原反应,
发生的离子反应为3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,
故答案为:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O;
(B)氢氧化钡溶液中滴加明矾溶液至Ba2+完全沉淀,二者的物质的量之比为2:1,
其离子反应为2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,
继续加入明矾溶液又发生Al3++3AlO2-+6H2O═4Al(OH)3↓,
故答案为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O;Al3++3AlO2-+6H2O═4Al(OH)3↓;
(2)(A)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质,则铁置换出Cu,Cu置换出Ag,所以还原剂Fe>Cu>Ag,
故答案为:Fe;
(B)铁钉在氯气中被锈蚀成棕褐色物质(FeCl3),而在盐酸中生成淡绿色溶液(FeCl2),显然氯气得电子的能力强,所以氧化性为Cl2>氢离子,故答案为:Cl2.
发生的离子反应为3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,
故答案为:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O;
(B)氢氧化钡溶液中滴加明矾溶液至Ba2+完全沉淀,二者的物质的量之比为2:1,
其离子反应为2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,
继续加入明矾溶液又发生Al3++3AlO2-+6H2O═4Al(OH)3↓,
故答案为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O;Al3++3AlO2-+6H2O═4Al(OH)3↓;
(2)(A)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质,则铁置换出Cu,Cu置换出Ag,所以还原剂Fe>Cu>Ag,
故答案为:Fe;
(B)铁钉在氯气中被锈蚀成棕褐色物质(FeCl3),而在盐酸中生成淡绿色溶液(FeCl2),显然氯气得电子的能力强,所以氧化性为Cl2>氢离子,故答案为:Cl2.
点评:本题考查离子反应方程式的书写及氧化还原反应,明确发生的化学反应是解答本题的关键,并熟悉离子反应方程式的书写方法、氧化性、还原性的比较方法来解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (1)按要求完成下列表格:
(1)按要求完成下列表格:
| 实验要求 | 化学试剂(写化学式) | 主要操作 |
| 除去NO气体中混有的NO2 | ______ | ______ |
| 除去SiO2固体中混有的Al2O3 | ______ | ______ |
| 除去Na2CO3溶液中的NaHCO3 | ______ | - |
| 除去NaCl溶液中混有的I2水溶液 | ______ | ______ |
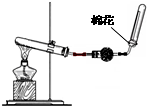
①用化学方程式表示实验室制取氨气的反应原理______.
②若试管内只装有碳酸氢铵固体,需把加热所得气体进行适当处理可获得纯净的氨气,则在球形干燥管中装放的固体药品名称为
______(装置部分夹持仪器已省去).
 (1)按要求完成下列表格:
(1)按要求完成下列表格: