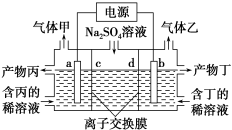
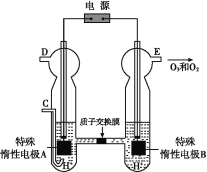
��Ŀ����
����Ŀ����֪����2H2(g)+O2(g)=2H2O(l);��H=��572kJ/mol
��2H2(g)+O2(g)=2H2O(g);��H=��484kJ/mol
��CH4(g)+2O2(g)=2H2O(l)+CO2(g);��H=��890kJ/mol
��1����֪H-H�ļ���436kJ/molO=O�ļ���496kJ/molH-O�ļ���463kJ/mol�������������ݼ����٢���һ����Ӧ����ͨ������ֱ�Ӽ���ó� ��������д����Ӧ H2O ( l ) = H2O ( g )���ʱ��H= ��
��2���������ɼ���CO2��g��+4H2( g ) =CH4( g ) +2H2O( g )���ʱ��H= ��
��3���ڢ٢ڢ���������ʽ����һ����ȼ���ȵ��Ȼ�ѧ����ʽ �����Ӧ����ʽ����ţ���״���£�ȡ����������Ļ������11.2 L��ȫȼ�պ�ָ������£���ų�������Ϊ263.8kJ�������������м������������� ��
���𰸡���1���� +44 kJ��mol-1 ����2����H=-166 kJ��mol-1 ����3���� 2:3
��������
�����������1��������ָ���³�ѹ�£���1mol������Ӳ��������̬ԭ������Ҫ��������������֪H-H�ļ���436kJ/mol O=O�ļ���496kJ/mol H-O�ļ���463kJ/mol��ֻ�ܼ�����������������ˮ�����ķ�Ӧ�ȣ�����ֻ�ܼ��㷴Ӧ�ڵ��ʱ䣬��֪��Ӧ��2H2 ( g ) + O2 ( g ) = 2H2O ( l ) ��H1 = ��572 kJ/mol����Ӧ��2H2 ( g ) + O2 ( g ) = 2H2O ( g ) ��H 2= ��484kJ/mol�����ݸ�˹�����ɣ���-�٣�/2�ã�H2O ( l ) = H2O ( g ) ��H=����H 2-��H1��/2=����484kJ/mol+572 kJ/mol��/2=+44 kJ��mol-1��
��2����֪��Ӧ��CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ); ��H3 = ��890 kJ/mol�����ݸ�˹���ɣ���Ӧ��+��-�۵÷�Ӧ��CO2��g��+4H2( g ) =CH4( g ) +2H2O( g ) ��H=����H1 +��H 2��- ��H3=����572 kJ/mol��484kJ/mol��-����890 kJ/mol��=-166 kJ��mol-1��
��3��ȼ������1mol��ȼ����ȫȼ������1mol�ȶ�������ų�������������̼Ԫ��ȼ�յIJ��������CO2(g)����Ԫ�ر�����Һ̬��ˮ���ڢ٢ڢ���������ʽ��ֻ�Тٲ���ȼ���ȵ��Ȼ�ѧ����ʽ����״���£�ȡ����������Ļ������11.2 L��ȫȼ�պ�ָ������£���ų�������Ϊ263.8kJ�����������ʵ���Ϊxmol�����������ʵ���Ϊymol��![]() ��x=0.2mol �� y=0.3mol����������м�������������Ϊ2:3��
��x=0.2mol �� y=0.3mol����������м�������������Ϊ2:3��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�