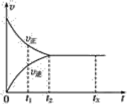题目内容
【题目】高铁酸钾(![]() )是新型的绿色环保水处理剂。一种制备
)是新型的绿色环保水处理剂。一种制备![]() 的流程如下:
的流程如下:
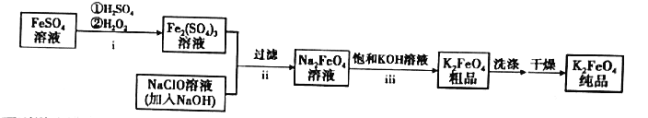
下列说法错误的是( )
A.步骤i中反应的离子方程式为![]()
B.步骤ⅱ说明碱性条件下,氧化性:![]()
C.步骤ⅲ的反应为复分解反应,说明溶解度:![]()
D.![]() 作为性能优良的水处理剂,主要是利用了其强氧化性和还原后产生的具有絮凝作用的Fe(Ⅲ)
作为性能优良的水处理剂,主要是利用了其强氧化性和还原后产生的具有絮凝作用的Fe(Ⅲ)
【答案】BC
【解析】
根据制备流程分析,FeSO4溶液在酸性条件下与H2O2发生氧化还原反应得到Fe2(SO4)3,Fe2(SO4)3与NaClO在碱性条件下发生氧化还原得到Na2FeO4,Na2FeO4与饱和的KOH溶液得到K2FeO4粗品,经洗涤干燥后得到K2FeO4纯品,据此分析解答问题。
A.由上述分析可知,步骤ⅰ为FeSO4溶液在酸性条件下与H2O2发生氧化还原反应生成H2O和Fe2(SO4)3,根据氧化还原反应规律可得反应的离子方程式为:2Fe2++H2O2+2H+===2Fe3++2H2O,A选项正确;
B.步骤ⅱ为Fe2(SO4)3与NaClO在碱性条件下发生氧化还原得到Na2FeO4,氧化剂是NaClO,氧化产物为Na2FeO4,因为氧化剂的氧化性大于氧化产物,故氧化性:NaClO>Na2FeO4,B选项错误;
C.步骤ⅲ为Na2FeO4与饱和的KOH溶液发生复分解反应得到K2FeO4粗品,溶解度大的物质转化为溶解度小的物质,故溶解度:Na2FeO4>K2FeO4,C选项错误;
D.由于K2FeO4具有强氧化性,因此可用于水的杀菌消毒,且其还原产物产生的Fe3+水解得到Fe(OH)3的胶体,具有絮凝的作用,故K2FeO4是乙中性能优良的水处理剂,D选项正确;
答案选BC。

【题目】下列实验方案的设计能达到相应实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 验证 | 向 |
B | 比较HF与 | 常温下,用pH试纸分别测定浓度均为 |
C | 验证 | 向 |
D | 比较Fe与Cu的金属活动性 | 常温下,将Fe、Cu与浓硝酸组成原电池 |
A.AB.BC.CD.D
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
【题目】下表是元素周期表中的一部分,回答下列问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ | ⑾ | ⑿ |
(1)写出下列元素名称①_______,⑤_______,⑨_______,⑾________。
(2)在这些元素中,金属性最强的元素是_______;除稀有气体元素以外的元素中原子半径最大的是_______,原子半径最小的是______。其氢化物最稳定的是____。(填写元素符号)
(3)元素②和③形成的离子的电子层结构_________(填“相同”或“不相同”),两者形成的化合物是否是离子化合物________(填“是”或否”),该化合物的电子式为______________。
(4)元素⑧的最高价氧化物对应的水化物化学式为:______名称为______:。
(5)在这些元素的最高价氧化物对应的水化物中,属于两性氢氧化物的是_________(填写化学式),写出其和盐酸反应的化学方程式__________________________________________。