题目内容
 金属镍(Ni)的应用越来越广泛.
金属镍(Ni)的应用越来越广泛.(1)LiNiO2常用作锂离子电池的正极材料,负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料.这种锂离子电池的电池反应式为:xLi+Li1-xNiO2
| 放电 |
| 充电 |
LiNiO2中,Ni元素的化合价为
+3价
+3价
;充电时,LiNiO2中化合价发生变化的元素有Li、Ni
Li、Ni
(填元素符号)(2)Ni常被镀在金属制品上以保护金属不生锈.镀镍的方法有:
方法Ⅰ:电镀镍.以NiSO4为电镀液.
①待镀零件与电源
负极
负极
相连,金属镍板与电源正极
正极
相连.方法Ⅱ:化学镀.将待镀零件浸泡在含有Ni2+和H2PO2-的溶液中,在酸性等条件下发生下述反应:(a)
2
2
Ni2++1
1
H2PO2-+1
1
→2
2
Ni++1
1
H2PO3-+2H+
2H+
(b)6H2PO2-+2H+=2P+4H2PO3-+3H2↑
上述反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的.
②请在答题卡上写出并配平反应式(a).
③化学镀与电镀相比较,在原理上的相同点是:
都利用氧化还原反应
都利用氧化还原反应
.Ni(s)+4CO(g)| 323~353K |
| 453~473K |
(3)Ni可以与CO(g)发生反应:
利用该反应可以提纯粗Ni,得到高纯度的金属Ni.
①该反应的平衡常数表达式为
| C(Ni(CO)4) |
| C4(CO) |
| C(Ni(CO)4) |
| C4(CO) |
②生产中,在如图所示密闭容器中充入CO气体,粗Ni放置在
A
A
(填编号)A.低温区 B.高温区.
分析:(1)根据同一化合物中各元素的化合价的代数和为0判断;根据各元素的化合价判断(注意会判断充电时的反应物、生成物的);
(2)①电镀时,镀件连接电源的负极,镀层连接电源的正极;
②根据氧化还原反应中得失电子式相等配平方程式,注意结合原子守恒、电荷守恒;
③根据是否有化合价的变化判断;
(3)①反应平衡常数=
,注意在反应平衡常数表达式中固体或纯液体不能写;
②根据方程式结合温度对化学平衡的影响分析.
(2)①电镀时,镀件连接电源的负极,镀层连接电源的正极;
②根据氧化还原反应中得失电子式相等配平方程式,注意结合原子守恒、电荷守恒;
③根据是否有化合价的变化判断;
(3)①反应平衡常数=
| C(Ni(CO)4) |
| C4(CO) |
②根据方程式结合温度对化学平衡的影响分析.
解答:解:(1)在化合物中各元素的化合价的代数和为0,在LiNiO2中锂元素的化合价为+1,氧元素的化合价为-2,所以镍元素的化合价为+3;充电时,反应物为LiNiO2,LiNiO2中锂元素的化合价为+1,氧元素的化合价为-2,镍元素的化合价为+3,生成物是Li和Li1-xNiO2,单质镍的化合价为0价,Li1-xNiO2中锂元素的化合价为+1,氧元素的化合价为-2,镍元素的化合价为4+x,所以变化的元素有锂和镍,故答案为:+3价;Li、Ni;
(2)①电镀时,镀件连接电源的负极,镀层连接电源的正极,故答案为:负极;正极;
②该反应中一个Ni2+得到1个电子生成Ni+,一个H2PO2-失去2个电子生成H2PO3-,所以得失电子的最小公倍数为2,故Ni2+的计量数为2,H2PO2-的计量数为2,然后根据原子守恒、电荷守恒配平方程式,所以该方程式为2Ni2++1H2PO2-+1H2O=2Ni++1H2PO3-+2H+,
故答案为:2;1;1;2;1;2H+;
③化学镀与电镀都有元素化合价的变化,所以都是利用氧化还原反应,故答案为:都利用氧化还原反应;
(3)①该反应的平衡常数=
,故答案为:
;
②要使该反应向正反应方向进行,温度应控制在323~353K之间,所以粗Ni放置在低温区,故选A.
(2)①电镀时,镀件连接电源的负极,镀层连接电源的正极,故答案为:负极;正极;
②该反应中一个Ni2+得到1个电子生成Ni+,一个H2PO2-失去2个电子生成H2PO3-,所以得失电子的最小公倍数为2,故Ni2+的计量数为2,H2PO2-的计量数为2,然后根据原子守恒、电荷守恒配平方程式,所以该方程式为2Ni2++1H2PO2-+1H2O=2Ni++1H2PO3-+2H+,
故答案为:2;1;1;2;1;2H+;
③化学镀与电镀都有元素化合价的变化,所以都是利用氧化还原反应,故答案为:都利用氧化还原反应;
(3)①该反应的平衡常数=
| C(Ni(CO)4) |
| C4(CO) |
| C(Ni(CO)4) |
| C4(CO) |
②要使该反应向正反应方向进行,温度应控制在323~353K之间,所以粗Ni放置在低温区,故选A.
点评:本题考查了电镀、氧化还原反应方程式的配平、化合价的判断等知识点,难度不大,注意反应平衡常数表达式中不写固体和纯液体物质的浓度.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
 (3)Ni可以与CO(g)发生反应:
(3)Ni可以与CO(g)发生反应: 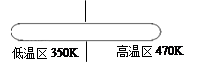 A.低温区 B.高温区
A.低温区 B.高温区 LiNiO2
LiNiO2
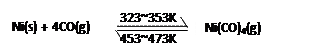 (3)Ni可以与CO(g)发生反应:
(3)Ni可以与CO(g)发生反应: A.低温区 B.高温区
A.低温区 B.高温区 LiNiO2
LiNiO2
 (3)Ni可以与CO(g)发生反应:
(3)Ni可以与CO(g)发生反应: 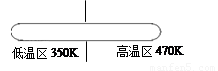 A.低温区
B.高温区
A.低温区
B.高温区 LiNiO2
LiNiO2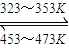 Ni(CO)4(g)
Ni(CO)4(g)