题目内容
10.A、B、C、D均为中学化学常见的物质,它们间的反应关系如图所示.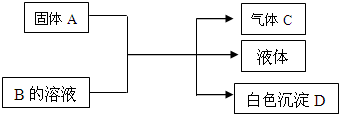
(1)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则B的化学式为(NH4)2SO4.有关反应的化学方程式为(NH4)2SO4+Ba(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$BaSO4↓+2NH3↑+2H2O.
(2)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液.
①A是NaHCO3时,该反应的离子方程式为:Al3++3HCO3-═Al(OH)3↓+3CO2↑.
②A是一种淡黄色固体,且A与B以物质的量之比为3:1相混合时,推知B的化学式为:Al2(SO4)3.
分析 (1)若A是可溶性强碱,B是正盐,二者反应生成气体,应为铵盐,D不溶于稀硝酸,则A为Ba(OH)2,B为(NH4)2SO4,D为BaSO4、C为NH3;
(2)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液,可推知D为氢氧化铝沉淀.
①A是NaHCO3时,应是铝离子与碳酸氢根发生水解反应反应生成氢氧化铝沉淀与二氧化碳;
②A是一种淡黄色固体,且A与B以物质的量之比3:1反应时,生成的D的量最多,即氢氧离子与铝离子为3:1,则A为Na2O2,B为 Al2(SO4)3.
解答 解:(1)若A是可溶性强碱,B是正盐,二者反应生成气体,应为铵盐,D不溶于稀硝酸,则A为Ba(OH)2,B为(NH4)2SO4,D为BaSO4、C为NH3,反应方程式为:(NH4)2SO4+Ba(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$BaSO4↓+2NH3↑+2H2O,
故答案为:(NH4)2SO4;(NH4)2SO4+Ba(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$BaSO4↓+2NH3↑+2H2O;
(2)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液,可推知D为氢氧化铝沉淀,B是铝盐,
①A是NaHCO3时,应是铝离子与碳酸氢根发生水解反应反应生成氢氧化铝沉淀与二氧化碳,反应离子方程式为:Al3++3HCO3-═Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-═Al(OH)3↓+3CO2↑;
②A是一种淡黄色固体,且A与B以物质的量之比3:1反应时,生成的D的量最多,即氢氧离子与铝离子为3:1,则A为Na2O2,B为 Al2(SO4)3,
故答案为:Al2(SO4)3.
点评 本题考查无机物推断,需要学生熟练掌握元素化合物性质,属于猜测验证型题目,难度中等.

| A. | 80mL 10mol•L-1 盐酸与足量MnO2加热反应,产生Cl2分子数为0.2NA | |
| B. | 2 L0.5 mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA | |
| D. | 标准状况下,11.2LSO3所含的分子数大于0.5NA |
| A. | 铁碳合金发生电化腐蚀时,电子由碳流向铁 | |
| B. | 6NO(g)+4NH3(g)═5N2(g)+6H2O(l)常温下能自发进行,则该反应△H>0 | |
| C. | 常温下,用水稀释0.1mol•L-1NH4Cl溶液,则$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{H}_{4}^{+})•(O{H}^{-})}$的值不变 | |
| D. | 对于溴乙烷的水解反应(△H>0),加入NaOH 并加热,该反应的反应速率和平衡常数均增大 |
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 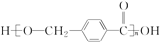 分子中只存在羧基、羟基两种官能团 分子中只存在羧基、羟基两种官能团 | |
| C. | PETG的结构简式为: 合成PETG的单体有4种 合成PETG的单体有4种 | |
| D. | 化合物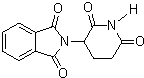 在酸性条件下水解,所得溶液加碱后加热有NH3生成 在酸性条件下水解,所得溶液加碱后加热有NH3生成 |
| 选项 | 甲 | 乙 |
| A | 物质的粒子数 | 阿伏加德罗常数 |
| B | 标况下气体的体积 | 标况下气体摩尔体积 |
| C | 固体的体积 | 固体的密度 |
| D | 溶液的物质的量浓度 | 溶液的体积 |
| A. | 1.31a% | B. | 2.25a% | ||
| C. | (100-3a)% | D. | 条件不够无法确定 |
