题目内容
已知下列变化过程中,有0.2 mol![]() ——
——![]() RO2+
RO2+![]() Mn2++H2O
Mn2++H2O
(1)推算出x值为__________;
(2)配平该离子方程式______________________;
(3)反应中还原剂为___________________;
(4)在上述变化过程中,参加反应的H+的物质的量为_________mol。
解析:(1)设![]() 中元素R的化合价为y,由题意可知:
中元素R的化合价为y,由题意可知:
![]()
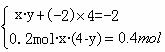
解得x=2, y=+3。
(2)用化合价升降法配平如下:
![]()
用观察法结合电荷守恒配平其他物质的化学计量数,结果为5、2、16——10、2、8。
(3)![]() 在反应中R元素化合价由+3升高到+4,作还原剂。
在反应中R元素化合价由+3升高到+4,作还原剂。
(4)由(2)中离子方程式可知,有16 mol H+参加反应时,转移电子的物质的量为10 mol,故转移0.4 mol电子时,参加反应的H+的物质的量为![]() ×0.4 mol=0.64 mol。
×0.4 mol=0.64 mol。
答案:
(1)2
(2)![]() +16H+====10RO2+2Mn2++8H2O
+16H+====10RO2+2Mn2++8H2O
(3)![]() (4)0.64
(4)0.64

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
 l2________ mL。
l2________ mL。