题目内容
工业上用铝土矿(主要成分为Al2O3,还含有少量Fe2O3、SiO2等杂质)提取氧化铝
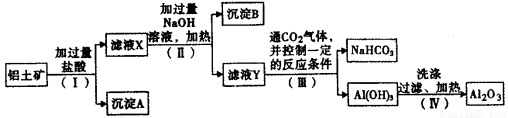
操作过程如下:
(1)沉淀A中主要含有 (填化学式),沉淀B中含有 (填化学式);
(2)(Ⅰ)(Ⅱ)步骤中分离溶液和沉淀的操作名称是 ;
(3)滤液X中,除了H+、Fe3+外,还含有大量的阳离子是 ;
(4)写出(Ⅳ)步骤中氢氧化铝加热分解的化学方程式: ;
练习册系列答案
相关题目
已知450℃时,反应H2(g)+I2(g)  2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g)  H2(g)+I2(g)的化学平衡常数为( )
H2(g)+I2(g)的化学平衡常数为( )
A.50 B.0.02 C.100 D.无法确定
下列四个试管中,发生如下反应:CaCO3 + 2HCl=CaCl2+H2O +CO2↑,产生气体的速率最快的是
+CO2↑,产生气体的速率最快的是
试管 | CaCO3的状态 | 盐酸的浓度 | 温度 |
A | 块状 | 1mol·L-1 | 20℃ |
B | 粉末状 | 1m | 20℃ |
C | 块状 | 2mol·L-1 | 40℃ |
D | 粉末状 | 2mol·L-1 | 40℃ |
(1)该氢氧化钠溶液的物质的量浓度为 ;
(2)由于实验需要,现还需该浓度氢氧化钠溶液230 mL,需要临时配制。
①应选择 mL的容量瓶,使用容量瓶前应进行的操作是 ;
②需要的玻璃仪器除了容量瓶、量筒外,还有 ;
③用托盘天平称取 g NaOH
④经过测定,某同学配制的氢氧化钠浓度偏高,则可能的原因是 ;
A.容量瓶中残存少量蒸馏水 |
B.称取NaOH固体时,直接在纸片上称取 |
C.溶解的NaOH溶液未冷却到室温,就转移到容量瓶中并定容 |
D.洗涤烧杯内壁后将洗涤液弃去 |
E.定容时,俯视容量瓶刻度线
F.定容、摇匀后发现溶液的凹液面低于刻度线
(3)取该氢氧化钠溶液20 mL,然后把溶液稀释至100 mL,则稀释后的溶液中OH﹣的物质的量浓度为 ;


 CO(g)+H2(g);△H =+131.3kJ/mol表示( )
CO(g)+H2(g);△H =+131.3kJ/mol表示( ) ol·L-1
ol·L-1 是
是 C.C12H22O11(蔗糖) D.Al
C.C12H22O11(蔗糖) D.Al