题目内容
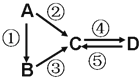
【题目】铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:

请回答下列问题:
(1)若A为H2O(g),可以得到Fe3O4,写出H2O的电子式:________________。
(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+生成Fe3+的离子方程式___________________。
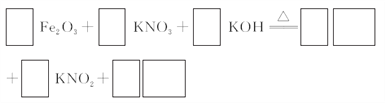
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共熔制得高铁酸钾的化学方程式,并配平:___________
(4)为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00 mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1 00 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00 mL。
已知:2Fe3++2I-===2Fe2++I2 ;I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() 。
。
①写出滴定选用的指示剂________,滴定终点观察到的现象_______________________。
②溶液Ⅰ中铁元素的总含量为__________g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会________(填“偏高”“偏低”或“不变”)。
【答案】 略 6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O 略 淀粉 滴加最后一滴标准液溶液蓝色消失且半分钟不恢复 5.6 偏高
【解析】(1) H2O的电子式为:![]() ;(2) NaClO3在酸性条件下将Fe2+氧化生成Fe3+的离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O;(3)KNO3和KOH的混合物,写出其与Fe2O3加热共融制得K2FeO4,则缺项中有一种为K2FeO4,K2FeO4中铁元素化合价为+6,则铁离子从+3价变为+6价,化合价升高3价,化合价至少升高3×2=6价;KNO3中N元素从+5降为KNO2中的+3价,化合价降低2价,则化合价最小公倍数为6,所以氧化铁的系数为1,KNO3的系数为3,然后根据质量守恒定律配平,配平后的方程式为:Fe2O3+3KNO3+2KOH=K2FeO4+3KNO2+H2O;(4) ①Fe3+氧化I-生成I2,淀粉遇碘变蓝,选择淀粉溶液作指示剂;滴加最后一滴标准液溶液蓝色消失且半分钟不恢复说明是终点,②若滴定前溶液中H2O2没有除尽,过量的H2O2氧化KI得到I2,根据关系式2Fe3+~I2,I2的量增大使所测定的铁元素的含量偏高。
;(2) NaClO3在酸性条件下将Fe2+氧化生成Fe3+的离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O;(3)KNO3和KOH的混合物,写出其与Fe2O3加热共融制得K2FeO4,则缺项中有一种为K2FeO4,K2FeO4中铁元素化合价为+6,则铁离子从+3价变为+6价,化合价升高3价,化合价至少升高3×2=6价;KNO3中N元素从+5降为KNO2中的+3价,化合价降低2价,则化合价最小公倍数为6,所以氧化铁的系数为1,KNO3的系数为3,然后根据质量守恒定律配平,配平后的方程式为:Fe2O3+3KNO3+2KOH=K2FeO4+3KNO2+H2O;(4) ①Fe3+氧化I-生成I2,淀粉遇碘变蓝,选择淀粉溶液作指示剂;滴加最后一滴标准液溶液蓝色消失且半分钟不恢复说明是终点,②若滴定前溶液中H2O2没有除尽,过量的H2O2氧化KI得到I2,根据关系式2Fe3+~I2,I2的量增大使所测定的铁元素的含量偏高。

【题目】(1)为了检验和除去下表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内。
物质 | 检验试剂 | 除杂试剂 |
(Ⅰ)甲烷(乙烯) | ________。 | ________。 |
(Ⅱ)酒精(水) | ________。 | ________。 |
①检验试剂:
A.无水硫酸铜 B.酸性高锰酸钾溶液
C.水 D.氢氧化钠溶液
②除杂试剂:
a.无水硫酸铜 b.乙酸
c.新制的生石灰 d.溴水
除杂时,乙烯发生反应的化学方程式为____________________。
(2)如图,在左试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。按图连接好装置,用酒精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
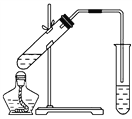
试回答:
在右试管中通常加入________溶液,实验生成的乙酸乙酯,其密度比水________,是有特殊香味的液体。分离右试管中所得乙酸乙酯的操作为(只填名称)________。反应中加入浓硫酸的作用是_____________________________________________________。