题目内容
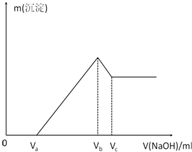 将Mg、Al混合粉末加入1mol/L的HCl溶液中充分反应,固体全部溶解,生成标况下的气体x ml,再向反应后的溶液中加入1mol/L的NaOH溶液,产生沉淀的物质的量与所加NaOH溶液的体积的关系如图所示.求:
将Mg、Al混合粉末加入1mol/L的HCl溶液中充分反应,固体全部溶解,生成标况下的气体x ml,再向反应后的溶液中加入1mol/L的NaOH溶液,产生沉淀的物质的量与所加NaOH溶液的体积的关系如图所示.求:
(1)若Va=30ml,Vb=80ml,Vc=90ml,求:
①HCl溶液的体积V(HCl)=______ml.
②Mg、Al的物质的量之比为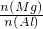 =______.
=______.
③产生气体的体积为x=______ml.
(2)若Va=30ml,Vc=90ml,求Vb的取值范围.
解:(1)①根据图象知,0-Va段发生的反应为:HCl+NaOH=NaCl+H2O,Va-Vb段发生的反应为:MgCl2+2NaOH=Mg(OH)2+2 NaCl、2AlCl3+6NaOH=2Al(OH)3+3 NaCl,Vb-Vc段发生的反应为:Al(OH)3+NaOH=NaAlO2+2H2O,所以当沉淀最大量时,溶液中溶质是氯化钠,
根据HCl+NaOH=NaCl+H2O知,盐酸的体积= =80mL,
=80mL,
故答案为:80mL;
②根据Al---Al(OH)3---OH-知,铝的物质的量= =0.01mol;
=0.01mol;
根据Mg--Mg(OH)2知n(Mg)= mol=0.01mol,
mol=0.01mol,
所以镁和铝的物质的量之比=0.01mol:0.01mol=1,
故答案为:1;
③根据转移电子守恒知,生成氢气的体积= =0.56L=560mL,
=0.56L=560mL,
故答案为:560;
(2)当金属全部为铝时,需要的氢氧化钠Vb最少,根据2AlCl3+6NaOH=2Al(OH)3+3 NaCl和Al(OH)3+NaOH=NaAlO2+2H2O知,(Vb-Va):(Vc-Vb)=3:1,则Vb=30mL+ =75mL,
=75mL,
当金属全部为镁时,需要的氢氧化钠Vb最多,(Vc-Vb)的氢氧化钠全部和镁离子反应生成氢氧化镁沉淀,则 Vc=Vb=90mL,实际上金属是镁铝合金,所以氢氧化钠的体积介于二者之间,即75<Vb<90,
故答案为:75<Vb<90.
分析:(1)①根据图象知,0-Va段发生的反应为:HCl+NaOH=NaCl+H2O,Va-Vb段发生的反应为:MgCl2+2NaOH=Mg(OH)2+2 NaCl、2AlCl3+6NaOH=2Al(OH)3+3 NaCl,Vb-Vc段发生的反应为:Al(OH)3+NaOH=NaAlO2+2H2O,所以当沉淀最大量时,溶液中溶质是氯化钠,根据氯化钠中原子守恒计算盐酸的体积;
②根据生成偏铝酸钠需要氢氧化钠的量计算生成氢氧化铝需要氢氧化钠的量,则Va-Vb之间氢氧化钠的量减去和铝离子反应的氢氧化钠的量就是和镁离子反应的氢氧化钠的量,再根据原子守恒计算镁铝的物质的量之比;
③根据转移电子守恒计算生成气体的体积;
(2)采用极限法进行计算.
点评:本题考查了镁、铝和酸、碱之间的反应,明确图象中各段发生的化学反应是解本题关键,注意(2)题中采用极限法来分析解答,难度中等.
根据HCl+NaOH=NaCl+H2O知,盐酸的体积=
 =80mL,
=80mL,故答案为:80mL;
②根据Al---Al(OH)3---OH-知,铝的物质的量=
 =0.01mol;
=0.01mol;根据Mg--Mg(OH)2知n(Mg)=
 mol=0.01mol,
mol=0.01mol,所以镁和铝的物质的量之比=0.01mol:0.01mol=1,
故答案为:1;
③根据转移电子守恒知,生成氢气的体积=
 =0.56L=560mL,
=0.56L=560mL,故答案为:560;
(2)当金属全部为铝时,需要的氢氧化钠Vb最少,根据2AlCl3+6NaOH=2Al(OH)3+3 NaCl和Al(OH)3+NaOH=NaAlO2+2H2O知,(Vb-Va):(Vc-Vb)=3:1,则Vb=30mL+
 =75mL,
=75mL,当金属全部为镁时,需要的氢氧化钠Vb最多,(Vc-Vb)的氢氧化钠全部和镁离子反应生成氢氧化镁沉淀,则 Vc=Vb=90mL,实际上金属是镁铝合金,所以氢氧化钠的体积介于二者之间,即75<Vb<90,
故答案为:75<Vb<90.
分析:(1)①根据图象知,0-Va段发生的反应为:HCl+NaOH=NaCl+H2O,Va-Vb段发生的反应为:MgCl2+2NaOH=Mg(OH)2+2 NaCl、2AlCl3+6NaOH=2Al(OH)3+3 NaCl,Vb-Vc段发生的反应为:Al(OH)3+NaOH=NaAlO2+2H2O,所以当沉淀最大量时,溶液中溶质是氯化钠,根据氯化钠中原子守恒计算盐酸的体积;
②根据生成偏铝酸钠需要氢氧化钠的量计算生成氢氧化铝需要氢氧化钠的量,则Va-Vb之间氢氧化钠的量减去和铝离子反应的氢氧化钠的量就是和镁离子反应的氢氧化钠的量,再根据原子守恒计算镁铝的物质的量之比;
③根据转移电子守恒计算生成气体的体积;
(2)采用极限法进行计算.
点评:本题考查了镁、铝和酸、碱之间的反应,明确图象中各段发生的化学反应是解本题关键,注意(2)题中采用极限法来分析解答,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
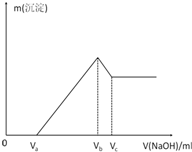 将Mg、Al混合粉末加入1mol/L的HCl溶液中充分反应,固体全部溶解,生成标况下的气体x ml,再向反应后的溶液中加入1mol/L的NaOH溶液,产生沉淀的物质的量与所加NaOH溶液的体积的关系如图所示.求:
将Mg、Al混合粉末加入1mol/L的HCl溶液中充分反应,固体全部溶解,生成标况下的气体x ml,再向反应后的溶液中加入1mol/L的NaOH溶液,产生沉淀的物质的量与所加NaOH溶液的体积的关系如图所示.求: