题目内容
高温下CuO和CO中发生如下反应:CuO(s)+CO(g)  Cu(s)+CO2(g)。
Cu(s)+CO2(g)。
已知该反应在不同温度下的平衡常数如下:
|
温度/℃ |
1 000 |
1 150 |
1 300 |
|
平衡常数 |
4.0 |
3.7 |
3.5 |
请回答下列问题:
(1) 该反应的平衡常数表达式K=________,ΔH________0(填“>”“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Cu、CuO、CO、CO2各1.0mol,反应经过10min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=________、CO的平衡转化率=__;
(3) 欲提高(2)中CO的平衡转化率,可采取的措施是__ __。
A.减少Cu的量 B.增加CuO的量 C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
(1)K=c(CO2)/c(CO) < (2)0.006mol/(L.min) 60%(3) C
【解析】(1)平衡常数是在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知,平衡常数K=c(CO2)/c(CO)。随着温度的升高,平衡常数逐渐减小,所以正反应是放热反应,即△H<0。
(2)设CO的转化率是x,则平衡时CO和CO2的物质的量分别是(1-x)mol和(1+x)mol,则根据平衡常数表达式可知,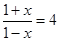 ,解得x=0.6mol。所以CO的转化率是60%,CO2的反应速率是
,解得x=0.6mol。所以CO的转化率是60%,CO2的反应速率是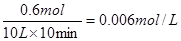 。
。
(3)由于反应是体积不变的、放热的可逆反应,所以升高温度平衡向逆反应方向移动,转化率降低,D不正确。同样改变压强,平衡不移动,转化率不变,E不正确。催化剂只能改变反应速率,但不能改变平衡状态,F不正确。固体不能影响反应速率和平衡状态,AB不正确。降低生成物浓度,平衡向正反应方向移动,转化率增大,C正确,答案选C。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案高温下CuO和CO中发生如下反应:CuO(s)+CO(g) Cu(s)+CO2(g)。
Cu(s)+CO2(g)。
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=________,ΔH________0(填“>”“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Cu、CuO、CO、CO2各1.0mol,反应经过10min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=________、CO的平衡转化率=__;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是__ __。
A.减少Cu的量 B.增加CuO的量 C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
高温下CuO和CO中发生如下反应:CuO(s)+CO(g) Cu(s)+CO2(g)。已知该反应在不同温度下的平衡常数如下:
Cu(s)+CO2(g)。已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=________,ΔH________0(填“>”“<”或“=”);
(2)在一个容积为10 L的密闭容器中,1 000 ℃时加入Cu、CuO、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=________、CO的平衡转化率=________;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是__ __。
A.减少Cu的量 B.增加CuO的量 C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
 Cu(s)+CO2(g)。
Cu(s)+CO2(g)。 __ __。
__ __。 u的量 B.增加CuO的量 C.移出部分CO2
u的量 B.增加CuO的量 C.移出部分CO2