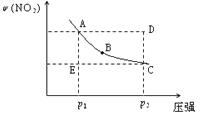
题目内容
【题目】关于相同体积pH均为3的醋酸和盐酸,下列说法正确的是
A. 稀释10倍后,两者的pH变化醋酸大于盐酸
B. 中和相同浓度的氢氧化钠溶液,消耗氢氧化钠的物质的量盐酸大于醋酸
C. 加入一定量的锌粉,产生气体的体积相同,则醋酸一定过量
D. 加入足量的锌粉,产生氢气的速率随时间的变化如图所示

【答案】C
【解析】A、醋酸是弱酸,存在电离平衡CH3COOH![]() CH3COO-+H+,HCl属于强酸,pH相等时,醋酸的浓度大于盐酸,因此稀释相同倍数时,盐酸pH变化大于醋酸,故A错误;B、盐酸属于强酸,醋酸属于弱酸,相同pH时醋酸的浓度大于盐酸,因此中和相同浓度的NaOH时,醋酸消耗氢氧化钠的物质的量大于盐酸,故B错误;C、因为pH相同,则等体积时醋酸物质的量大于盐酸物质的量,产生气体体积相同,醋酸过一定过量,若醋酸恰好完全反应,则醋酸产生气体最多,故C正确;D、醋酸是弱酸,消耗H+,促进醋酸的电离,则 反应开始后,醋酸溶液中c(H+)大于盐酸,即醋酸溶液中反应速率比盐酸中快,故D错误。
CH3COO-+H+,HCl属于强酸,pH相等时,醋酸的浓度大于盐酸,因此稀释相同倍数时,盐酸pH变化大于醋酸,故A错误;B、盐酸属于强酸,醋酸属于弱酸,相同pH时醋酸的浓度大于盐酸,因此中和相同浓度的NaOH时,醋酸消耗氢氧化钠的物质的量大于盐酸,故B错误;C、因为pH相同,则等体积时醋酸物质的量大于盐酸物质的量,产生气体体积相同,醋酸过一定过量,若醋酸恰好完全反应,则醋酸产生气体最多,故C正确;D、醋酸是弱酸,消耗H+,促进醋酸的电离,则 反应开始后,醋酸溶液中c(H+)大于盐酸,即醋酸溶液中反应速率比盐酸中快,故D错误。

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目