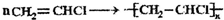题目内容
 (2013?河东区一模)短周期元素X、Y、Z、W原子序数依次增大.X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中.请回答:
(2013?河东区一模)短周期元素X、Y、Z、W原子序数依次增大.X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中.请回答:(1)Y在元素周期表中的位置是
第三周期第IIIA族
第三周期第IIIA族
;X氢化物的电子式是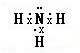
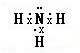
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈
酸性
酸性
(填“酸”、“碱”或“中性”),用离子方程式表示其原因是NH4++H2O?NH3.H2O+H+
NH4++H2O?NH3.H2O+H+
.(3)Y-AgO电池是应用广泛的鱼类电池,其原理如图所示.该电池的负极反应式是
Al+4OH--3e-=AlO2-+2H2O
Al+4OH--3e-=AlO2-+2H2O
.(4)Z和W比较.非金属性较弱的是
Si
Si
(填元素符号),下列可以验证这一结论的是bcd
bcd
(填序号).a、元素在地壳中的含量
b、最高价氧化物对应水化物的酸性
c、断开氢化物中1molH-Z或H-W键所需的能量
d、Z与W以共价键形成化合物时,Z或W显示的电性
(5)含W的物质通常有漂白、杀菌作用.其中可作水消毒剂的有
ClO2、NaClO
ClO2、NaClO
(写出其中两种物质的化学式).(6)由Z和W组成的化合物遇水立即水解产生两种酸,写出此反应的化学方程式
SiCl4+3H2O=H2SiO3+4HCl或 SiCl4+4H2O=H4SiO4+4HCl
SiCl4+3H2O=H2SiO3+4HCl或 SiCl4+4H2O=H4SiO4+4HCl
.分析:短周期元素X、Y、Z、W原子序数依次增大,X氢化物的水溶液显碱性,则X是N元素;Y在元素周期表中所处的周期序数与族序数相等,且Y的原子序数大于X,所以Y是Al元素;Z单质是将太阳能转化为电能的常用材料,则Z是Si元素;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中,则W是Cl元素,结合元素周期律知识解答.
解答:解:短周期元素X、Y、Z、W原子序数依次增大,X氢化物的水溶液显碱性,则X是N元素;Y在元素周期表中所处的周期序数与族序数相等,且Y的原子序数大于X,所以Y是Al元素;Z单质是将太阳能转化为电能的常用材料,则Z是Si元素;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中,则W是Cl元素,
(1)Y是Al元素,铝原子核外有3个电子层,最外层有3个电子,所以在元素周期表中位于第三周期第IIIA族,X的氢化物是氨气,其电子式为: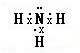 ,故答案为:第三周期第IIIA族,
,故答案为:第三周期第IIIA族,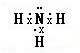 ;
;
(2)氨水和盐酸恰好反应时生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解导致溶液中氢离子浓度大于氢氧根离子浓度而使其水溶液呈酸性,故答案为:酸,NH4++H2O?NH3.H2O+H+;
(3)该装置是原电池,铝作负极,负极上铝失电子发生氧化反应,电极反应式为:Al+4OH--3e-=AlO2-+2H2O,故答案为:Al+4OH--3e-=AlO2-+2H2O;
(4)硅的非金属性小于氯元素,比较非金属强弱的方法有:其最高价含氧酸的酸性强弱、吸引电子的能力等,
故选bcd;
(5)含氯化合物有杀菌消毒作用的是ClO2、NaClO,故答案为:ClO2、NaClO;
(6)由Si和Cl组成的化合物遇水立即水解产生两种酸硅酸和盐酸,其反应方程式为:SiCl4+3H2O=H2SiO3+4HCl 或 SiCl4+4H2O=H4SiO4+4HCl,
故答案为:SiCl4+3H2O=H2SiO3+4HCl 或 SiCl4+4H2O=H4SiO4+4HCl.
(1)Y是Al元素,铝原子核外有3个电子层,最外层有3个电子,所以在元素周期表中位于第三周期第IIIA族,X的氢化物是氨气,其电子式为:
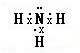 ,故答案为:第三周期第IIIA族,
,故答案为:第三周期第IIIA族,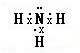 ;
;(2)氨水和盐酸恰好反应时生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解导致溶液中氢离子浓度大于氢氧根离子浓度而使其水溶液呈酸性,故答案为:酸,NH4++H2O?NH3.H2O+H+;
(3)该装置是原电池,铝作负极,负极上铝失电子发生氧化反应,电极反应式为:Al+4OH--3e-=AlO2-+2H2O,故答案为:Al+4OH--3e-=AlO2-+2H2O;
(4)硅的非金属性小于氯元素,比较非金属强弱的方法有:其最高价含氧酸的酸性强弱、吸引电子的能力等,
故选bcd;
(5)含氯化合物有杀菌消毒作用的是ClO2、NaClO,故答案为:ClO2、NaClO;
(6)由Si和Cl组成的化合物遇水立即水解产生两种酸硅酸和盐酸,其反应方程式为:SiCl4+3H2O=H2SiO3+4HCl 或 SiCl4+4H2O=H4SiO4+4HCl,
故答案为:SiCl4+3H2O=H2SiO3+4HCl 或 SiCl4+4H2O=H4SiO4+4HCl.
点评:本题考查原子结构和元素性质,正确推断元素是解本题关键,涉及盐类水解、电极反应式的书写等知识点,注意铝和氢氧化钠构成的原电池中负极电极反应式的书写,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目



 .
.