题目内容
近年来,国际原油价格大幅上涨,促使各国政府加大生物能源生产,其中酒精汽油已进入实用化阶段.
(1)乙醇在铜或银作催化剂的条件下,可以被空气中的氧气氧化成X,X可发生银镜反应,请写出X被银氨溶液氧化的反应方程式(标出具体反应条件):
(2)乙醇可以与酸性重铬酸钾溶液反应,被直接氧化成Y,Y含有官能团的名称是
(3)现有两瓶无色液体,分别盛有Y、W,只用一种试剂就可以鉴别,该试剂可以是
(4)现代石油化工采用银作催化剂,乙烯能被氧气氧化生成环氧乙烷( ),该反应的原子利用率为100%,反应的化学方程式为
),该反应的原子利用率为100%,反应的化学方程式为
(1)乙醇在铜或银作催化剂的条件下,可以被空气中的氧气氧化成X,X可发生银镜反应,请写出X被银氨溶液氧化的反应方程式(标出具体反应条件):
CH3CHO+2[Ag(NH3)2]OH
CH3COONH4+2Ag↓+3NH3+H2O
| 水浴 |
CH3CHO+2[Ag(NH3)2]OH
CH3COONH4+2Ag↓+3NH3+H2O
;| 水浴 |
(2)乙醇可以与酸性重铬酸钾溶液反应,被直接氧化成Y,Y含有官能团的名称是
羧基
羧基
,在浓硫酸存在下加热,乙醇与Y反应可生成一种有香味的物质W,化学方程式为:CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O
| 催化剂 |
| 加热 |
CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O
;| 催化剂 |
| 加热 |
(3)现有两瓶无色液体,分别盛有Y、W,只用一种试剂就可以鉴别,该试剂可以是
碳酸钠
碳酸钠
;(4)现代石油化工采用银作催化剂,乙烯能被氧气氧化生成环氧乙烷(
 ),该反应的原子利用率为100%,反应的化学方程式为
),该反应的原子利用率为100%,反应的化学方程式为2CH2=CH2+O2
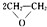
| 加热 |
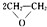
2CH2=CH2+O2
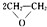
.| 加热 |
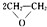
分析:(1)乙醇与氧气发生催化氧化生成乙醛和水,乙醛和新制的银氨溶液发生氧化还原反应;
(2)与酸性重铬酸钾溶液具有强氧化性,乙醇可直接氧化成乙酸;
(3)鉴别乙酸乙酯和乙酸,利用它们的化学性质进行鉴别;
(4)根据化学反应符合“绿色化学”思想,原子利用率100%,利用已知的反应物和生成物,即可写出方程式;
(2)与酸性重铬酸钾溶液具有强氧化性,乙醇可直接氧化成乙酸;
(3)鉴别乙酸乙酯和乙酸,利用它们的化学性质进行鉴别;
(4)根据化学反应符合“绿色化学”思想,原子利用率100%,利用已知的反应物和生成物,即可写出方程式;
解答:解:(1)乙醇的催化氧化:2CH3CH2OH+O2
2CH3CHO+2H2O,乙醛和新制的银氨溶液发生氧化还原反应生成乙酸铵和单质银,反应的方程式为 CH3CHO+2[Ag(NH3)2]OH
CH3COONH4+2Ag↓+3NH3+H2O,
故答案为:CH3CHO+2[Ag(NH3)2]OH
CH3COONH4+2Ag↓+3NH3+H2O;
(2)乙醇被硫酸酸化的重铬酸钾溶液氧化成乙酸,重铬酸钾被还原为硫酸铬,
2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O,乙醇和乙酸之间可以发生酯化反应:
CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O,
故答案为:羧基,CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O;
(3)乙酸具有酸性,它能和碳酸钠反应放出二氧化碳气体,而乙酸乙酯不能,故答案为:碳酸钠;
(4)乙烯能被氧气氧化生成环氧乙烷,根据质量守恒定律该反应为:2CH2=CH2+O2
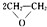 ,
,
故答案为:2CH2=CH2+O2
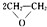 ;
;
| Cu或Ag |
| △ |
| 水浴 |
故答案为:CH3CHO+2[Ag(NH3)2]OH
| 水浴 |
(2)乙醇被硫酸酸化的重铬酸钾溶液氧化成乙酸,重铬酸钾被还原为硫酸铬,
2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O,乙醇和乙酸之间可以发生酯化反应:
CH3CH2OH+CH3COOH
| 催化剂 |
| 加热 |
故答案为:羧基,CH3CH2OH+CH3COOH
| 催化剂 |
| 加热 |
(3)乙酸具有酸性,它能和碳酸钠反应放出二氧化碳气体,而乙酸乙酯不能,故答案为:碳酸钠;
(4)乙烯能被氧气氧化生成环氧乙烷,根据质量守恒定律该反应为:2CH2=CH2+O2
| 加热 |
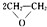 ,
,故答案为:2CH2=CH2+O2
| 加热 |
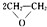 ;
;点评:本题考查有机物的性质,抓住物质的官能团,尤其注意典型有机物和常见官能团的性质,是解答本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
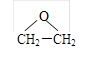 ,该
,该 ),该反应的原子利用率为100%,反应的化学方程式为
。
),该反应的原子利用率为100%,反应的化学方程式为
。